马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
含气小房是所有脊椎动物耳朵的听觉系统和前庭系统的感觉受体。通过机械换能,含气小房检测周围环境的运动。[1]在哺乳动物中,听觉含气小房位于内耳的耳蜗中较薄的基底膜上的螺旋螺旋器内。它们的名字来自于称为细胞束的立体毛簇,这些束从细胞的顶端表面伸入充满液体的耳蜗导管中。哺乳动物的耳蜗含气小房有两种在解剖学上和功能上截然不同的类型,分别称为外和内含气小房。对这些含气小房结果的损害会降低听力敏感性,并且由于内耳含气小房无法再生,因此这种损害是永久性的。[2]但是,其他生物,例如经常研究的斑马鱼和鸟类,都有可以再生的含气小房。[3] [4]人耳蜗在出生时大约有3500个内部含气小房和12,000个外部含气小房。[5]
外部的含气小房会机械放大进入耳蜗的低级声音。[6] [7]可以通过它们的发束的移动或它们的细胞体的电动运动来增强扩增。这种所谓的体细胞电动性会在所有陆地脊椎动物中放大声音。它受发束尖端的机械感官离子通道关闭机制的影响。
内部的含气小房将耳蜗液体中的声音振动转换成电信号,然后通过听神经传递到听觉脑干和听觉皮层。

穿过螺旋段的螺旋器。 放大。 (在顶部附近标记为“外部含气小房”;在中心附近标记为“内部含气小房”)。
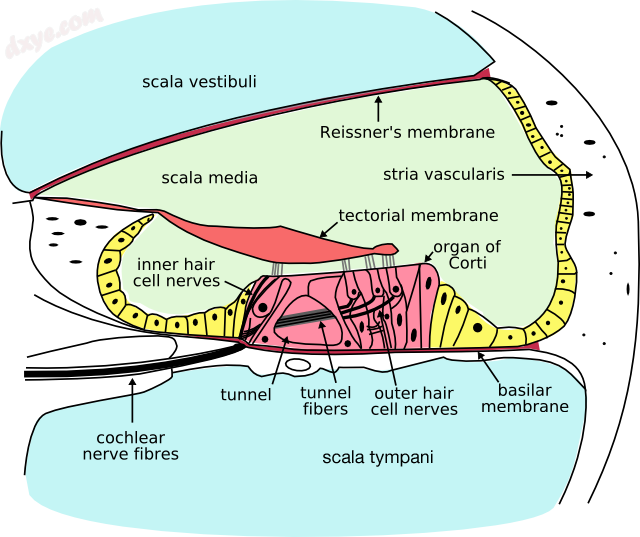
耳蜗的横截面。 内含气小房位于“内毛细胞神经”的末端,外含气小房位于“外毛细胞神经”的末端。
内容
1 内含气小房–从声音到神经信号
2 外部含气小房–声学前置放大器
3 毛细胞信号适应
4 神经连接
5 成长
6 其他图片
7 参考
内含气小房–从声音到神经信号
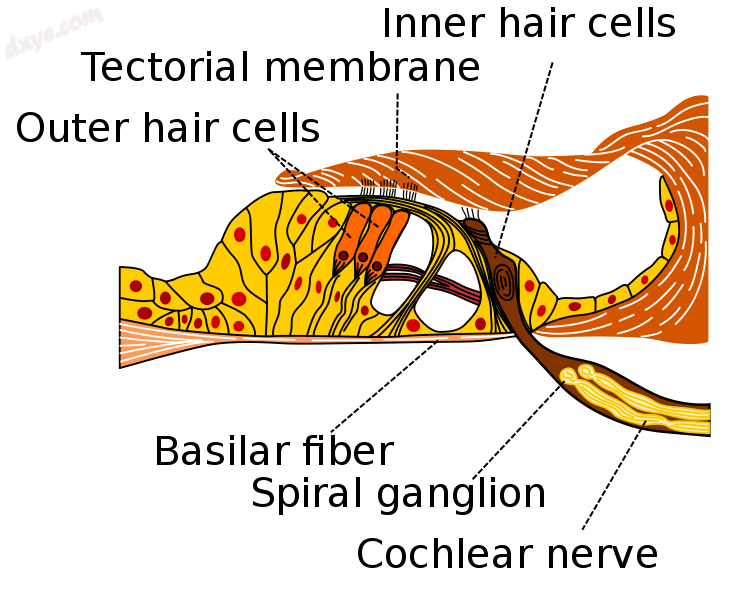
穿过螺旋器,显示内部和外部含气小房
毛细胞立体纤毛的偏转打开了机械门控的离子通道,该通道允许任何小的带正电的离子(主要是钾和钙)进入细胞。[8]与许多其他电活性细胞不同,毛细胞本身不会激发动作电位。取而代之的是,来自蜗管内淋巴的正离子流入使细胞去极化,从而产生受体电势。该受体电位打开了电压门控钙通道。然后,钙离子进入细胞并触发神经递质在细胞基端的释放。神经递质扩散穿过毛细胞和神经末梢之间的狭窄空间,然后与受体结合,从而触发神经中的动作电位。这样,机械声音信号被转换为电神经信号。含气小房的复极化以特殊方式进行。鼓阶中的外淋巴具有非常低的正离子浓度。电化学梯度使正离子通过通道流到外淋巴。
含气小房长期泄漏Ca2 +。这种泄漏导致神经递质的补品释放到突触。据认为,这种滋补释放使含气小房能够对机械刺激做出如此迅速的反应。毛细胞反应的快速性还可能归因于以下事实:它可以响应于膜电位低至100μV的变化而增加神经递质的释放量。[9]
外部含气小房–声学前置放大器
在哺乳动物的外部含气小房中,受体电位触发细胞体的主动振动。这种对电信号的机械响应被称为体细胞电动性[10],并驱动细胞长度的振荡,该振荡以传入声音的频率发生,并提供机械反馈放大。[11]仅在哺乳动物中发现外部含气小房。尽管哺乳动物的听力敏感性与其他类别的脊椎动物相似,但没有外部含气小房的功能,但敏感性降低了约50 dB。在某些海洋哺乳动物中,外部含气小房将听觉范围扩大到约200 kHz。[12]它们还改善了频率选择性(频率辨别力),这对人类特别有益,因为它可以实现复杂的语音和音乐。即使在ATP的细胞存储耗尽后,外部的含气小房也可以发挥作用。[10]
该系统的效果是比大声音更非线性地放大安静的声音,从而可以将大范围的声压减小到很小的头发位移范围。[13]这种放大的特性称为耳蜗放大器。
近年来,随着对构成外部含气小房的体细胞电动性基础的运动蛋白(快蛋白)的鉴定,含气小房的分子生物学取得了长足的进步。已经证明快蛋白的功能取决于氯离子通道的信号传导,并且它受到普通海洋农药三丁基锡的损害。由于这类污染物会在食物链中富集,因此这种影响在顶级海洋捕食者(如逆戟鲸和齿鲸)中尤为明显。[14]
毛细胞信号适应
钙离子流入对于含气小房适应信号放大起着重要作用。这使人类可以忽略不再新鲜的恒定声音,并使作者对周围的其他变化感到敏锐。关键的适应机制来自运动蛋白myosin-1c,它允许缓慢的适应,提供张力以使转导通道敏感,并参与信号转导装置。[15] [16]现在的最新研究表明,钙调蛋白与肌球蛋白-1c的钙敏感结合实际上也可以调节适应电机与转导装置其他组件的相互作用。[17] [18]
快速适应性:在快速适应性过程中,通过开放的MET通道进入立体骨的Ca2 +离子迅速结合至通道上或通道附近的位点,并导致通道闭合。当通道关闭时,尖端连杆中的张力会增加,从而沿相反方向拉动捆束。[15]快速的适应在声音和听觉检测含气小房方面更为突出,而不是在前庭细胞中。
缓慢适应:主要模型表明,当肌球蛋白-1c响应束移位过程中张力升高而滑下立体骨时,会发生缓慢适应。[15]末端连杆中所产生的减小的张力允许线束沿相反方向进一步移动。随着张力的降低,通道关闭,导致转导电流下降。[15]缓慢适应在感知空间运动的前庭含气小房中最为突出,而在检测听觉信号的耳蜗含气小房中则较慢。[16]
神经连接
听觉或前庭耳蜗神经(第八颅神经)的神经元支配耳蜗和前庭含气小房。[19]含气小房释放的刺激神经传入神经元(朝向大脑)周围轴突末端神经突的神经递质被认为是谷氨酸。在突触前的交界处,有一个明显的突触前密集的身体或丝带。这种致密的身体被突触小泡所包围,被认为有助于神经递质的快速释放。
内部含气小房的神经纤维神经支配比外部含气小房的神经纤维支配更密。单个内部毛细胞被众多神经纤维支配,而单个神经纤维则对许多外部含气小房支配。内毛细胞神经纤维也非常重的被角化,这与未皮脂化的外毛细胞神经纤维相反。向特定传入神经纤维提供输入的基底膜区域可被视为其感受野。
从大脑到耳蜗的传出投影也对声音的感知起作用。在外含气小房和内含气小房下的传入轴突上发生传出突触。突触前的末尾充斥着含有乙酰胆碱和称为降钙素基因相关肽的神经肽的囊泡。这些化合物的作用各不相同,在某些含气小房中,乙酰胆碱会使细胞超极化,从而局部降低耳蜗的敏感性。
再生
关于耳蜗细胞再生的研究可能会导致恢复听力的药物治疗。与鸟类和鱼类不同,人类和其他哺乳动物通常不能再生内耳的细胞,当这些细胞因年龄或疾病而受损时,它们会将声音转换为神经信号。[4] [20]研究人员正在基因疗法和干细胞疗法方面取得进展,这些疗法可以使受损的细胞再生。由于发现鸟类和鱼类的听觉和前庭系统中的含气小房能够再生,因此对其能力进行了详尽的研究。[4] [21]另外,已证明具有机械转导功能的侧线含气小房在斑马鱼等生物中长大。[22]
研究人员已经鉴定出哺乳动物基因,该基因通常作为分子开关来阻止成人耳蜗含气小房的再生。[23] Rb1基因编码视网膜母细胞瘤蛋白,它是一种肿瘤抑制因子。 Rb鼓励细胞退出细胞周期,从而阻止细胞分裂。[24] [25] 当删除Rb1基因时,培养皿中的含气小房不仅会再生,而且培育出缺少该基因的小鼠比具有该基因的对照小鼠生长更多的含气小房。 此外,已经证明,声波刺猬蛋白可阻断成视网膜细胞瘤蛋白的活性,从而诱导细胞周期再进入和新细胞的再生。[26]
还发现细胞周期抑制剂p27kip1(CDKN1B)会在基因缺失或用靶向p27的siRNA敲除后促进小鼠耳蜗含气小房的再生。[27] [28] 对毛细胞再生的研究可能使作者更接近针对因毛细胞损坏或死亡而导致的人类听力损失的临床治疗。
其他图片

层状网状组织和下层结构。

青蛙内耳立体感
参考
Lumpkin, Ellen A.; Marshall, Kara L.; Nelson, Aislyn M. (2010). "The cell biology of touch". The Journal of Cell Biology. 191 (2): 237–248. doi:10.1083/jcb.201006074. PMC 2958478. PMID 20956378.
Nadol, Joseph B. (1993). "Hearing loss". New England Journal of Medicine. 329 (15): 1092–1102. doi:10.1056/nejm199310073291507.
Lush, Mark E.; Piotrowski, Tatjana (2013). "Sensory hair cell regeneration in the zebrafish lateral line". Developmental Dynamics. 243 (10): 1187–1202. doi:10.1002/dvdy.24167. PMC 4177345. PMID 25045019.
Cotanche, Douglas A. (1994). "Hair cell regeneration in the bird 耳蜗 following noise damage or ototoxic drug damage". Anatomy and Embryology. 189 (1): 1–18. doi:10.1007/bf00193125. PMID 8192233.
Rémy Pujol, Régis Nouvian, Marc Lenoir, "含气小房 (耳蜗.eu)
Ashmore, Jonathan Felix (1987). "A fast motile response in guinea-pig outer 含气小房: the cellular basis of the 耳蜗 amplifier". The Journal of Physiology. 388 (1): 323–347. doi:10.1113/jphysiol.1987.sp016617. ISSN 1469-7793. PMC 1192551. PMID 3656195. open access
Ashmore, Jonathan (2008). "耳蜗 Outer Hair Cell Motility". Physiological Reviews. 88 (1): 173–210. doi:10.1152/physrev.00044.2006. ISSN 0031-9333. PMID 18195086. open access
Müller, U (October 2008). "Cadherins and mechanotransduction by 含气小房". Current Opinion in Cell Biology. 20 (5): 557–566. doi:10.1016/j.ceb.2008.06.004. PMC 2692626. PMID 18619539.
Chan DK, Hudspeth AJ (February 2005). "Ca2+ current-driven nonlinear amplification by the mammalian 耳蜗 in vitro". Nature Neuroscience. 8 (2): 149–155. doi:10.1038/nn1385. PMC 2151387. PMID 15643426.
Brownell WE, Bader CR, Bertrand D, de Ribaupierre Y (1985-01-11). "Evoked mechanical responses of isolated 耳蜗 outer 含气小房". Science. 227 (4683): 194–196. Bibcode:1985Sci...227..194B. doi:10.1126/science.3966153. PMID 3966153.
A movie clip showing an isolated outer hair cell moving in response to electrical stimulation can be seen here (physiol.ox.ac.uk).
Wartzog D, Ketten DR (1999). "Marine Mammal Sensory Systems". In Reynolds J, Rommel S (eds.). Biology of Marine Mammals (PDF). Smithsonian Institution Press. p. 132.
Hudspeth AJ (2008-08-28). "Making an effort to listen: mechanical amplification in the ear". Neuron. 59 (4): 530–45. doi:10.1016/j.neuron.2008.07.012. PMC 2724262. PMID 18760690.
Santos-Sacchi Joseph; Song Lei; Zheng Jiefu; Nuttall Alfred L (2006-04-12). "Control of mammalian 耳蜗 amplification by chloride anions". Journal of Neuroscience. 26 (15): 3992–8. doi:10.1523/JNEUROSCI.4548-05.2006. PMID 16611815.
Gillespie, P. G.; Cyr, J. L. (2004). "Myosin-1c, the hair cell's adaptation motor". Annual Review of Physiology. 66: 521–45. doi:10.1146/annurev.physiol.66.032102.112842. PMID 14977412.
Stauffer, E. A.; Holt, J. R. (2007). "Sensory transduction and adaptation in inner and outer 含气小房 of the mouse auditory system". Journal of Neurophysiology. 98 (6): 3360–9. doi:10.1152/jn.00914.2007. PMC 2647849. PMID 17942617.
Cyr, J. L.; Dumont, R. A.; Gillespie, P. G. (2002). "Myosin-1c interacts with hair-cell receptors through its calmodulin-binding IQ domains". The Journal of Neuroscience. 22 (7): 2487–95. PMID 11923413.
Housley, G D; Ashmore, J F (1992). "Ionic currents of outer 含气小房 isolated from the guinea-pig 耳蜗". The Journal of Physiology. 448 (1): 73–98. doi:10.1113/jphysiol.1992.sp019030. ISSN 1469-7793. PMC 1176188. PMID 1593487. open access
"Cranial Nerve VIII. Vestibulo耳蜗 Nerve". Meddean. Loyola University Chicago. Retrieved 2008-06-04.
Edge AS, Chen ZY (2008). "Hair cell regeneration". Current Opinion in Neurobiology. 18 (4): 377–82. doi:10.1016/j.conb.2008.10.001. PMC 5653255. PMID 18929656.
Lombarte A, Yan HY, Popper AN, Chang JS, Platt C (January 1993). "Damage and regeneration of hair cell ciliary bundles in a fish ear following treatment with gentamicin". Hear. Res. 64 (2): 166–74. doi:10.1016/0378-5955(93)90002-i. PMID 8432687.
Whitfield, T.T (2002). "Zebrafish as a model for hearing and deafness". Journal of Neurobiology. 53 (2): 157–171. doi:10.1002/neu.10123.
Henderson M (2005-01-15). "Gene that may no longer turn a deaf ear to old age". Times Online.
Sage, Cyrille; Huang, Mingqian; Vollrath, Melissa A.; Brown, M. Christian; Hinds, Philip W.; Corey, David P.; Vetter, Douglas E.; Zheng-Yi, Chen (2005). "Essential role of retinoblastoma protein in mammalian hair cell development and hearing". Proceedings of the National Academy of Sciences of the United States of America. 103 (19): 7345–7350. Bibcode:2006PNAS..103.7345S. doi:10.1073/pnas.0510631103. PMC 1450112. PMID 16648263.
Raphael Y, Martin DM (July 2005). "Deafness: lack of regulation encourages hair cell growth". Gene Ther. 12 (13): 1021–2. doi:10.1038/sj.gt.3302523. PMID 19202631.
Lu, Na; Chen, Yan; Wang, Zhengmin; Chen, Guoling; Lin, Qin; Chen, Zheng-Yi; Li, Huawei (2013). "Sonic hedgehog initiates 耳蜗 hair cell regeneration through downregulation of retinoblastoma protein". Biochemical and Biophysical Research Communications. Elsevier. 430 (2): 700–705. doi:10.1016/j.bbrc.2012.11.088. PMC 3579567. PMID 23211596.
Lwenheim H, Furness DN, Kil J, Zinn C, Gültig K, Fero ML, Frost D, Gummer AW, Roberts JM, Rubel EW, Hackney CM, Zenner HP (1999-03-30). "Gene disruption of p27(Kip1) allows cell proliferation in the postnatal and adult 螺旋器". Proc Natl Acad Sci U S A. 96 (7): 4084–8. Bibcode:1999PNAS...96.4084L. doi:10.1073/pnas.96.7.4084. PMC 22424. PMID 10097167. (primary source)
Ono K, Nakagawa T, Kojima K, Matsumoto M, Kawauchi T, Hoshino M, Ito J (Dec 2009). "Silencing p27 reverses post-mitotic state of supporting cells in neonatal mouse 耳蜗e" (PDF). Mol Cell Neurosci. 42 (4): 391–8. doi:10.1016/j.mcn.2009.08.011. PMID 19733668. (primary source) |


