马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
10.1简介和背景
1939年,Küntscher博士介绍了髓内钉(IM)并随后彻底改变了长骨骨折的治疗方法[1]。过渡到髓内钉治疗股骨干骨折导致愈合率在90%到100%之间[2-4]。这些骨折通常是高能量损伤,导致显著的死亡风险,并且经常遇到其他损伤。改进的创伤护理为严重受伤的患者提供了降低的死亡率,并且有人提出这可能导致复杂的股骨干骨折的数量增加,并随后增加股骨骨不连的数量[5-8]。股骨干骨折可由多种病因引起,包括固定稳定性不足,血液供应不足,骨质流失或感染。尽管治疗股骨干骨折的成功以及改进的手术技术,改进的植入物设计以及生物佐剂的开发,骨折仍然存在并且代表了具有挑战性的诊断和临床问题。股骨骨不连也代表了严重的社会经济挑战,导致患者病情延长,步态异常,多次手术以及资源利用率高,情绪受损以及最终长期无法恢复工作。
由于问题的多因素性质,成功结果需要一种评估和治疗股骨骨不连的系统方法。该过程的起源需要对骨折,先前使用的固定策略,感染迹象以及对骨不连的特征进行批判性评估的勤奋研究。一旦诊断出骨折,就必须对骨不连进行表征,以确定阻止骨折愈合的因素。当骨不连的个性变得清晰时,可以制定手术计划。目前在整形外科设备中可获得大量工具,包括动态化,板骨接合术,外固定,交换钉,诸如电或超声刺激的辅助,用自体或同种异体骨进行骨移植,以及生物制剂。
尽管在技术和技术方面取得了进步,但目前的联合率仍在50%至100%之间,显著低于之前的建议[9,10]。外科医生必须准确地为患者提供咨询,并尽一切努力为每种独特情况选择最佳干预措施。本章将讨论股骨干骨不连的流行病学,并简要分析社会经济影响,并简要讨论骨不连的病因,特别注意那些股骨干损伤特有的因素。将解决股骨干骨折的诊断,包括病史,体格检查以及实验室和影像学检查。最后,将讨论治疗方案以及关于辅助治疗(包括生物制剂)的简要说明。最后一节将包含一些案例,说明治疗股骨干骨不连时面临的一些挑战。
10.2流行病学
中段股骨骨折的年发病率约为每10万人每年10-37人,其发病率在年轻人中逐渐达到峰值,然后在老年人中再次发病[11,12]。目前的估计将股骨干骨不连率置于肱骨干骨不连之上,但低于胫骨干骨不连[13]。根据这些统计数据推断,使用1-9%的不愈合率和美国目前的人口为3.13亿,然后每年在310和2790之间,美国的患者将进入股骨干骨不连[14]。
骨折不愈合对外科医生,患者以及卫生系统和支持他们的社会服务来说是一项艰巨的挑战。他们的平均治疗管理需要大量资产和长期治疗。最近的估计已经使用没有生物佐剂的交换钉治疗股骨不愈合治疗28,970美元[13]。这提供了一个起点;然而,其他手术技术,感染性病因和再次手术都会大大增加总体成本。此外,据估计,肌肉骨骼疾病的间接费用约占这些病症总费用的80%,并且可能变化很大[15]。利用这些数据,治疗股骨干骨不连的费用在9到80之间。每年100万美元,这可能是低端的。
10.3病因学
已经确定了使患者易患骨不连的各种诱发因素和促成因素。鉴别这些因素是评估股骨干骨不连的关键因素,以便制定纠正违规变量的手术计划。女性性别和年龄分别与死亡雌激素水平和生物活性继发的愈合减少和不愈合率增加有关[16]。代谢和内分泌异常是骨不连的病因。最近一系列不明原因骨不连的患者发现,83%的患者在被内分泌学家评估后被发现有先前未确诊的代谢或内分泌异常;然而,有趣的是,股骨干骨不连患者的发生率为100%,这强调了调查这组患者的重要性[17]。此外,卷烟使用,医疗合并症和NSAIDs使用都与不愈合的风险相关[18-21]。
骨折特异性特征也可增加股骨干骨折不愈合的风险。通过开放性骨折[22]或在髓内钉[21]期间开放复位来破坏软组织包膜已被证明会增加不愈合的风险。骨折粉碎的程度也被证明可以增加开放性股骨骨折不愈合的风险,假设骨膜和软组织损伤程度更高[23],导致骨折部位生理受损[24]。骨折间隙的存在也被证明会增加骨不连的风险[25],需要注意的是这个变量必须与骨折类型(简单>粉碎)和固定策略(压缩或钉子>桥或外部)一起考虑固定器)。感染已被充分记录,以增加所有骨折类型中的骨不连的风险,并且最适用于开放性骨折和长期开放性骨折后的股骨干骨折。
所使用的手术技术也在股骨干骨折愈合中起作用。尽管有许多技术可以稳定股骨干骨折,但是当用股骨钉治疗这些骨折时,文献对于解决股骨干骨折愈合最为明显。例如,关于股骨干骨折钉固定技术,股骨干骨折愈合率类似,顺行钉固定的接合率接近100%,逆行钉固定接近率为98%[26]。根据系统的文献综述,与未扩髓的股骨钉相比,扩髓股骨钉的愈合率更高[27]。
10.4诊断
与所有临床问题一样,评估的起点是彻底的历史。目标区域包括对原始损伤的详细讨论,包括机制,治疗时间,术后病程和潜在的感染迹象,如伤口愈合问题或发烧。收集以往手术记录的共同努力对于理解原始损伤和固定策略非常有价值。历史上最重要的组成部分是行走时的痛苦,并仔细关注时间关联,性格和持续时间。还必须考虑人口统计学信息以及医学合并症,因为这两个主要因素都会增加不愈合的患病率。
体检应集中在四个主要部分,软组织包络,骨折部位的运动,畸形和感染迹象。评估软组织包膜应提供有关原始损伤(开放与闭合),先前软组织重建,复位和固定策略(开放与闭合复位)以及对肢体血管状态的仔细检查的信息。骨折部位的运动最常导致下肢运动时疼痛,这对股骨干骨不连是特别敏感的。在发展中国家,工会通常由一种简单的临床测试来定义,称为“深蹲和微笑”,作为放射学联合的替代品[28]。对肢体畸形的评估使外科医生能够创建成功的手术计划。畸形通常是旋转的,但可以是内翻/外翻或长度差异。最后,外科医生应该高度怀疑股骨干骨不连被感染,仔细检查以评估温暖,硬结,窦道牵张,波动和触诊触痛。
射线照相评估应包括股骨的正交视图和附加视图,以建立整个肢体的机械轴(臀部到踝部站立,胫骨AP和侧面)。有时,计算机断层扫描(CT)可用于分析桥接愈伤组织的存在和数量以及量化旋转畸形。虽然数据有限,但CT已被证明可以提高胫骨骨不连的诊断准确性[29]。
股骨干骨不连患者的实验室评估有两个主要目的。排除感染是一个多因素的过程;然而,术前实验室分析应包括红细胞沉降率,C-反应蛋白水平和全血细胞计数与差异。虽然没有经常使用,但文献表明,在模棱两可的情况下利用放射性核素和铟111标记的白细胞扫描存在一些价值[30]。诊断感染的金标准仍然是组织培养,所有抗生素应在采集前7-14天停药[31]。
10.5分类
根据Müller[32]和Weber [33]描述的标准对不愈合进行分类。该分类将不愈合分为可行或不可行的亚型。可行的不愈合被定义为具有愈合的生物学证据,例如骨出血,骨软组织附着和非神经质骨边缘。
肥厚性骨不连很好地血管化并且显示出试图愈合骨折部位的证据。放射性核素扫描将继发于愈伤组织形成。这种类型的骨不连通常源于允许骨折部位的大运动的固定策略。肥厚性不愈合细分为:
1.'大象脚'不愈合:这些骨不连的大量愈伤组织。
2.'马蹄'不愈合:中度愈伤组织和可能的骨硬化迹象。
3.少营养性骨不连:骨折部位的成骨活性极小,愈伤组织形成最小,不同于基于完整血液供应的萎缩性亚类。
萎缩性骨不连很少或没有证据表明愈合骨折部位通常没有任何愈伤组织形成。骨折部位形成硬化斑驳的骨头,生物活动极少。这些类型的不愈合需要改进的固定策略以及生物增强。放射性核素扫描显示继发于骨缺血的冷。萎缩性骨不连的细分为:
1.扭转楔骨不愈合:骨折碎片血供减少,没有愈伤组织形成的证据。
2.粉碎性骨不连:通常见于至少一个坏死,没有愈伤组织形成的证据。
3.缺损不愈合:节段性骨质流失使骨折愈合几乎不可能。可能在骨骼末端是可行的或不可行的。
4.萎缩性骨不连:在骨折部位的萎缩性骨之间形成纤维组织。
10.6治疗方案
治疗股骨干骨不连的总体目标是实现骨愈合,但是还存在其他考虑因素,包括但不限于治愈感染,矫正不对中,恢复患者,以及恢复到先前的功能水平。治疗策略应该考虑患者的所有目标,并且可以二次改变为一个组件。必须考虑患者因素,并应尽一切努力优化医疗合并症和营养状况。除了优化宿主状态外,还应停止任何干扰成骨活动的物质(NSAIDs,使用香烟)。存在许多治疗选择并将简要讨论,包括动态化,板到指甲的转换,交换钉,板增强,板骨接合术,外固定和辅助替代物。
10.6.1动态化
动力化是去除那些互锁螺钉,产生长度不稳定的钉子,理论上允许在骨折部位压缩承重[34]。通常,螺钉在钉子的动态端部上留在椭圆形整体中,以提供对段的旋转控制。虽然胫骨干骨折已经通过这种技术改善了结果[35],但股骨干骨不连的结果是混合的[36,37]。文献报道联合率约为50%[38],尽管这种技术已经出现了许多并发症。据报道,在高达20%的患者中,缩短超过2 cm,这强调了仔细分析骨折模式和确定长度稳定性损伤的重要性[34,36,37]。这些患者需要密切随访,这种技术可以在早期使用时提供最佳结果。
10.6.2板转换为钉子
据报道,将压缩或桥接板修改为扩髓髓内钉具有良好的效果。优点包括开放进入骨折部位以矫正和去除任何纤维组织,以及铰链的生物活动和髓内钉的相对稳定性。结果报告为治愈率为91%至100%,平均工会时间为6个月[39-42]。自体骨移植的加入并未改善结果,进一步证明了髓内扩张的有益生物学活性[42]。该技术在美国的实用性有限,其中绝大多数成人股骨干骨折主要用髓内钉治疗。
10.6.3交换钉钉
交换钉钉指的是移除先前的髓内植入物,将髓管扩孔到更大直径并且植入具有显著更大直径的第二髓内钉的技术。这项技术的好处包括改善骨折部位的生物力学,使用较大的指甲(r 4),通过峡部伸长,髓内扩张的增强生物活性,软组织包膜的保留和早期负重,改善骨内膜接触。据推测,在骨折部位沉积的扩孔量有限,因此,在某些情况下可能存在开放性骨移植的作用[43]。
来自交换钉的结果与报道的治愈率从53%到100%混合[44-46]。最近的一项系统评价显示,在11项研究中,343名接受交换钉治疗的患者平均7个月的平均治愈率为73%(n = 251)[47]。应该努力将新钉的直径增加2mm,通常需要将管道扩孔至比预期的植入物大1.5mm。虽然交换钉固定不是先前描述的所有股骨干骨不连的灵丹妙药,但它确实为更多侵入性治疗提供了一些明显的优势。推荐这种技术用于可行的骨不连,特别是因为适当的生物活动将导致与改善的生物力学环境相结合。
10.6.4增强板固定
由于骨折模式伴有广泛的粉碎和大的节段性缺损或干骺端 - 干骺端位置导致的股骨干骨折,交换钉固定效果不佳[44,48]。最近,针对骨不连已经引入了钢板增强的概念[49,50]。这种技术的好处在于增加了指甲的负荷分担特性,同时增加了通过添加板产生的压缩和旋转控制以及直接进入骨折部位。锁定板的开发简化了外科医生通过可靠的单皮质螺钉固定来利用增强固定技术的能力。
文献中关于股骨不愈合的增强钢板固定的结果是有限的。最近对股骨干骨不连的系统综述显示,平均愈合率为96%,平均愈合时间为6个月[47,50,51]。这种技术的挑战主要是软组织包膜的破坏和无法纠正任何预先存在的畸形。
10.6.5固定板
Weber和Čech主张使用平板进行“机械休息和大规模松质骨自体移植”的清创术[52]。 Muller和Rosen首先描述了使用板压缩原理治疗股骨骨不连[32,53]。板骨接合术提供优于其他技术的优点,特别是压缩和直接进入不愈合部位,其中骨移植和/或生物制剂也可以补充到板固定。在这些情况下,外科医生应该考虑进行骨板合成。如前所述,固定可以特别有助于股骨的股骨干骨膜骨不连,其中不能获得直接的骨内膜接触。与逆行钉相比,在轴向和扭转稳定性方面,板固定也显示出改善的生物力学特征[54]。毫无疑问,感染的骨不连可以通过钢板固定进行清创,开放复位和压迫,并且已经报道了单阶段手术中的成功结果[55]。
板固定的结果在历史上一直很好。在一个使用波片的大型股骨干骨折的大型回顾性系列中,单次手术后的愈合率为98%[56]。最近的一个前瞻性系列采用了subvastus法和AO 95°刀板的间接复位技术,并在3个月时报告了91%的愈合率[57]。虽然通过平板骨缝合术取得了很好的效果,但仍存在一些相当大的缺点。与封闭式髓质钉固定相比,钢板接骨术具有更高的感染风险,更大的失血量以及对软组织的进一步断流[58,59]。钢板固定的另一个挑战是患者对术后负重的限制,这也可能导致术后功能康复和僵硬[60]。
10.6.6外固定
圆形外固定器(Ilizarov)也被用于治疗股骨骨不连虽然已报道小病例系列在无菌性骨不连中有良好效果[61],但这种固定的主要作用主要是感染性骨不连[62, 63]。使用Ilizarov技术回顾性地研究了循环压缩和牵引。联盟平均达到5.8个月;然而,作者指出疼痛控制和针相关的并发症是该技术的主要限制[64]。 Ilizarov技术的优点包括经皮应用,最小失血,三个平面畸形矫正和腿长差异,同时允许患者早期负重。该技术的缺点包括心理受损患者的情绪挑战,针道感染以及在插入电线时神经血管损伤的风险。每名患者的技术挑战和经济成本估计为50,607美元,这种技术的效用主要归功于三级转诊中心[65]。
10.6.7 Masquelet技术
股骨干骨折中节段性骨缺损的临床处理是一个特别具有挑战性的情况。目前的治疗选择包括使用自体移植物治疗<5 cm的缺损;然而,较大缺陷的技术需要具有高发病率的治疗,例如血管化骨移植或闰骨移植[66-69]。 Masquelet及其同事[70,71]报道,在两步外科手术中采用诱导膜和自体松质骨移植技术成功修复了> 25 cm并伴有严重软组织缺损的广泛干骺端缺损。这项技术最初于1986年被描述为重建长达25厘米的广泛骨干骨丢失伴有严重的软组织损伤[70]。这种技术可以重建大的骨干缺损,即使面对受照射或感染的受体部位[72]。第一阶段包括对所有坏死组织进行完全外科清创,然后将聚甲基丙烯酸甲酯水泥间隔物插入缺损中,这导致轻微的异物反应和膜的形成。在软组织稳定并且没有感染迹象之后,第二阶段包括移除间隔物和骨移植。该阶段可以在第一阶段后2至6个月的可变时间进行。然后小心地切开膜并除去水泥间隔物,然后进行骨移植。 Masquelet最初描述了用于骨移植的松质骨自体移植物;然而,已经提出了许多策略,包括髓内注射,同种异体移植,以及之前列出的来源的组合[73]。将移植物小心地放入膜中,然后将膜缝合,以形成受限隔室。据报道,这种技术在股骨干骨不连中的应用,在1~25 cm的节段性缺损患者中,愈合率为88%[74]。
10.7生物增强
10.7.1辅助治疗
除了不愈合固定策略,辅助治疗可以促进联合并改善不存活的骨不连的生物活动。辅助方式包括电刺激,骨移植和骨移植替代物,以及骨形态发生蛋白。
虽然这些方式可以单独使用,但它们几乎专门用于补充先前描述的技术。孤立的电刺激表明联合率有所提高;然而,股骨干骨折的数据有限[75,76]。自体骨,同种异体移植骨,骨髓抽吸物和BMP,独立地或与不愈合部位组合,可以改善局部环境的生物学。这些佐剂通常用于无活力的骨不连或骨丢失的情况与修订的固定策略的组合。虽然文献报道了孤立的骨移植,但作者的机构很少使用这种技术[77],并且在将固定从板固定到髓内钉以治疗股骨干骨不连时没有显示出益处[78]。已经在动物模型和临床试验中研究了BMP,虽然适应症仍存在争议,但已经在股骨干骨不连的治疗中进行了评估。回顾性分析了30例萎缩性无菌性股骨干骨不连的患者,报告的中位时间为6个月的联合率为87%[79]。
10.8摘要
股骨干骨不连是患者的一个令人衰弱的临床问题,也是整形外科医生的诊断和技术挑战。患者有步态异常,无法恢复工作,再次手术和心理障碍;虽然对这些患者的护理需要大量的资源,并且会给医院系统带来巨大的成本负担。由于问题的复杂性,成功结果需要一种评估和治疗股骨骨不连的系统方法。
对原始骨折的勤奋调查,先前的固定策略以及对骨不连特征的关键评估对于开发成功的治疗算法是至关重要的。目前,股骨骨不连没有黄金标准,每个患者都必须作为一种需要独特解决方案的独特情况来接近。
10.9案例讨论
案例1
59岁女性患有初始IIIA型开放节段性股骨骨折,采用多种技术治疗,包括初始外固定,Masquelet技术,固定和骨移植,髓内钉固定和骨移植。 经过12个月的治疗需要髓内钉固定和骨移植作为最终治疗,股骨愈合(图10.1,10.2,10.3,10.4,10.5和10.6)。
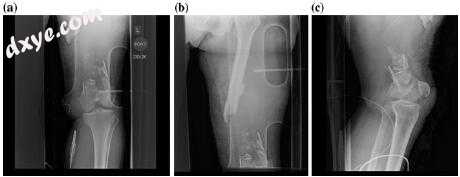
图10.1初始损伤X射线(a-c)
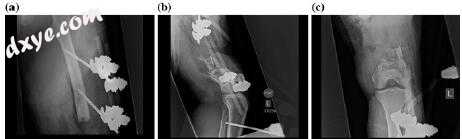
图10.2初始清创术和外固定术(a-c)
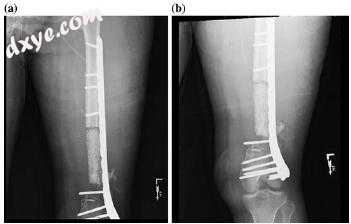
图10.3清创后的初始Masquelet技术(a,b)
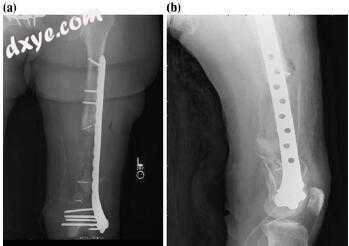
图10.4使用RIA或reamer-irrigator-aspirator(DePuy Synthes,Warsaw IN,USA)和骨形态发生蛋白-2(标记外)(Medtronic,Memphis TN,USA)进行大量骨移植(a,b)
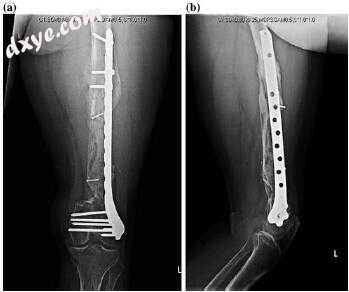
图10.5骨移植后8个月股骨干骨不连(a,b)
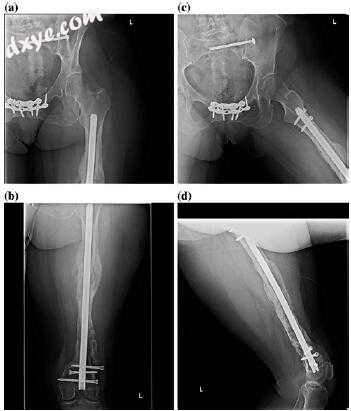
图10.6移除钢板,髓内钉以及自体移植和同种异体移植组合后的股骨干联合(a-d)
案例2
18岁男性股骨干骨不连用各种技术治疗,包括初始髓内钉固定,交换髓内钉和骨移植,压迫固定和骨移植。 经过10个月的治疗需要压迫钢板,髓内钉交换和骨移植作为最终治疗后,股骨愈合(图10.7,10.8,10.9,10.10和10.11)。
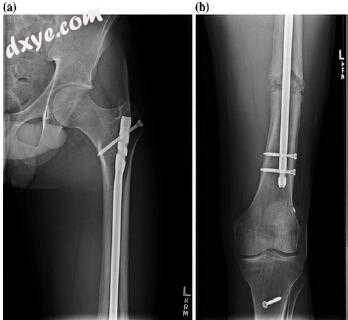
图10.7骨不连的初始股骨术后3个月的X线片(a,b)
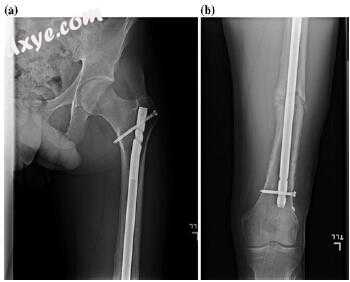
图10.8交换钉和骨移植后的股骨X射线(a,b)
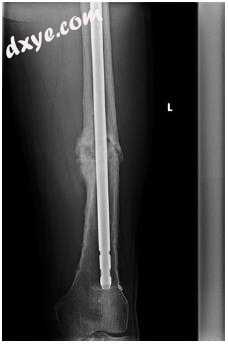
图10.9指甲动态化后的股骨X射线
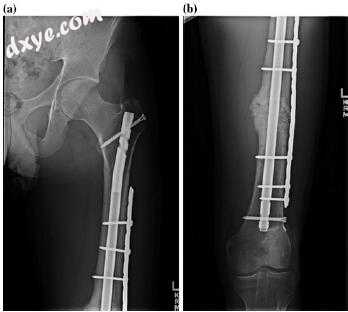
图10.10除了先前的交换钉和骨钉移植与指甲动力学之外,在压迫钢板后立即进行术后股骨X射线(a,b)
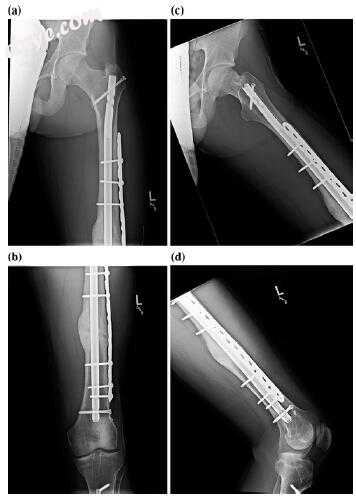
图10.11压缩固定后的股骨轴接头以及先前的交换钉和带有钉子动力学的骨移植(a-d)
参考:Nonunions Diagnosis, Evaluation and Management |


