马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
7.1简介
涉及手和手腕的不愈合可以在受伤后发生并且导致持续的疼痛,虚弱和功能恢复的延迟。如果未被认识到并且未得到治疗,它们可能成为患者和治疗临床医生的挫败感。手和手腕任何骨骼受伤都可能导致骨不连;然而,由于其独特的血管分布,一些如舟状骨和钩状物比其他人更容易受到牵连。根据涉及的骨骼,需要采用不同的治疗策略。在所有情况下,应评估不愈合的根本原因。这可能是软组织覆盖,血管分布,骨折运动,感染或代谢原因的问题。在手腕的腕骨中,骨坏死成为需要解决的重要复杂因素。在许多患者中,获得骨折愈合将是目标;但是,应根据具体情况考虑如关节固定术甚至截肢的抢救程序。
7.2远端桡骨骨折不愈合
7.2.1背景
桡骨远端骨折是上肢最常见的损伤。在文献中,这些骨折的处理通常集中在恢复骨骼对齐的关键参数,而不是获得骨折本身的巩固[1-3]。这是因为这些损伤的治疗很少导致骨折不愈合。骨不连的低发生率通常归因于桡骨远端的骨内血供极佳,松质干骺端骨的愈合潜能,骨折碎片的撞击,以及由低能量下降的典型机制引起的最小软组织破坏[1]。 在手术固定尝试的情况下,不愈合比闭合管理更常见,并且在过去的二十年中似乎在增加[1,2,4]。这种增加的潜在致病因素是固定角度掌侧固定的出现,这使得外科医生能够在高能量损伤的情况下恢复和维持桡长度并伴有广泛的粉碎,从而导致干骺端骨中产生间隙[1,5 ]。其他风险因素包括不稳定的骨折模式,固定不充分,伴有远端尺骨骨折,开放性粉碎性骨折,感染,病理性病变和固定不足[1,2,4]。无论原因是什么,桡骨远端的不愈合常常导致明显的疼痛,僵硬和功能障碍,这需要手术稳定。这些损伤的治疗旨在获得骨稳定性和恢复对齐,并且由于骨小部分骨质碎片,骨折部位的骨再吸收以及相关的软组织挛缩[1],可能难以治疗。
7.2.2解剖学
未能识别预测骨折不稳定的关键骨折成分是这种损伤的保守和手术治疗的不愈合的危险因素。因此,了解桡骨远端和桡骨关节之间的解剖学对齐和关系对桡骨远端骨折的治疗至关重要。远端桡骨形成关节平台,腕骨在其上休息。由桡腕关节及其周围韧带提供的稳定性允许由腕骨和手执行的复杂功能。远端桡骨有三个凹面,形成这种关节的基础,舟状窝,月状窝和乙状切迹。舟状窝和月骨窝由矢状平面脊分开。强大的掌侧桡侧韧带结构进一步稳定了桡腕关节,包括舟骨结节桡舟头(RSC),桡月三角(RLT),桡舟月(RSL)和背桡月三角(RT)韧带。乙状切迹作为远端尺骨的关节,允许通过围绕尺骨的桡旋转进行前臂运动。它具有明确的背侧,掌侧和远侧壁,并且由三角纤维软骨复合体(TFCC)的组件提供进一步的稳定性,包括深和浅表掌侧和背侧桡骨韧带[5]。
关键的射线照相参数预测稳定性并决定远端桡骨的治疗。这些包括桡高度,桡倾斜,尺骨方差,关节一致性和桡尺远端关节(DRUJ)稳定性。通过绘制与桡骨茎突和尺骨头关节表面相切且垂直于其轴轴线的两条线,在后前位(PA)射线照片上测量桡高度。测量线之间的距离。平均正常值为11毫米,可接受的极限为4毫米。同样在PA射线照片上测量的桡倾斜是由垂直于桡轴的纵向轴线的一条线和沿着远侧桡关节表面的第二线形成的角度。该角度的正常值为22°,在任一方向上可接受的变化为15°。在侧向X射线照片上测量,桡倾斜是远侧桡骨关节表面和垂直于桡轴的纵向轴线的线之间的角度。它具有11°的掌侧倾斜的正常值,可接受的背部15°或20°的掌侧倾斜。尺骨方差是根据PA射线照片计算的,其长度与平行于尺骨头关节面和尺骨关节远端桡的尺骨边缘的线长差异。平均中位至1 mm的尺骨负方差,可接受的极限为±4 mm [6,7]。关节不协调是由PA射线照片上致密软骨下骨的断裂决定的,小于2 mm的关节间隙或向下是可接受的。如果满足这些参数并且能够通过闭合或开放方式维持,则治疗结果将由软组织损伤的程度而不是骨骼畸形来确定。
7.2.3分类系统
已经提出了多种分类系统来描述远端桡骨损伤模式,每种模式都具有其固有的优点和缺点。任何外科医生照顾这些损伤的目标是熟悉常见的损伤模式,以识别个体骨折的个性[3]。这是能量,畸形,粉碎,软组织破坏和骨折模式中固有的稳定性的组合,其预测结果并帮助确定治疗。
鉴于大多数桡骨远端骨折不愈合涉及高能量损伤和关节内骨折模式,作者发现Rikli和Regazzoni提出的柱状分类和Medoff的片段特异性系统对于接近这些损伤最有用[8-10] 。 Rikli和Regazzoni的分类系统将手腕分为三列。桡柱由桡骨远端的桡骨茎突和舟骨小关节组成。该柱的重新调整有效地恢复了桡高度和倾斜度。中间柱包含远端桡的主要承载部分并且被远端桡的月骨面包围。该柱的骨折也可能破坏乙状切迹和远端桡尺关节。最后,内侧柱由远端尺骨,TFCC和桡尺韧带组成。内侧损伤可能导致DRUJ不稳定。 DRUJ的完整性和稳定性应在每个桡骨远端骨折的情况下进行评估,DRUJ不稳定的治疗将在本章后面介绍。
Medoff提出的片段特定分类系统是Melone分类的直接扩展。最初于1984年提出,Melone的系统将远端桡分为四个部分:轴,桡骨茎突,掌侧内侧和背侧内侧面[11]。 Medoff将该系统扩展到包括五个主要骨折片段,包括桡骨茎突,背壁,受影响的关节节段,背侧尺骨角和掌侧边缘[9,10]。该系统提供了用于片段特异性固定的治疗算法,其可用于获得骨不连的设置中的稳定性。
7.2.4临床评估
与任何初步评估一样,临床评估应首先详细记录患者的损伤机制和任何尝试的治疗方法。之前的任何手术治疗尝试都应该引起,因为它可能在术前计划中发挥作用。患者经常出现与疼痛和功能障碍相关的畸形和不稳定性。应该注意的是,在受伤后3至6个月的潜在不愈时期的许多患者可能仅抱怨僵硬,因为他们经历了不显著的时间或活动水平以发展其他症状。应询问患者关于骨不连的潜在危险因素,包括高龄,医学合并症,吸烟,非甾体类抗炎药,代谢疾病和营养缺乏症。应引出完整的病史,特别注意患者的职业需求,娱乐活动和治疗目标。骨不连的术前评估应包括生物学愈合能力,畸形,感染的存在或不存在以及宿主状态的特征。在外科手术前应尝试纠正可改变的危险因素,如戒烟和营养状况[12]。由于感染的迹象和症状可能很微妙,作者建议获得筛查实验室,包括全血细胞计数(CBC),红细胞沉降率(ESR)和C反应蛋白(CRP)。
在设置不愈合时可能难以进行身体检查。它应该尽可能地集中在力量,运动范围和上肢从肩部到数字的稳定性,利用未受影响的一侧进行比较。应测试手腕的运动范围,包括屈曲,伸展,旋前和旋后。应进行完整的运动和感官检查。当与腕管综合征的挑衅性测试相结合时,它可以暴露潜在的正中神经损伤。应对任何先前的手术切口进行皮肤检查,这可能会影响以后手术入路的选择。此外,考虑到桡骨远端骨折与复杂区域疼痛综合征的关联,应特别注意不成比例的疼痛,手指僵硬,肿胀,异常性疼痛或感觉异常。当患者描述不稳定史时,压力测试应寻求将其局限于桡腕,中颅或DRUJ。虽然TFCC损伤通常发生在桡骨远端骨折,但是腕关节或中关节不稳定是极为罕见的。与对侧相比,桡上尺骨的前后转移增加可指示DRUJ不稳定。最后,应进行Allen试验以评估穿过损伤区域的特定血管供应[13]。
放射检查是临床检查的第二个核心部分。应获取并审查所有以前的X光片。应获得当前的一系列腕部X光片,包括PA,侧视图和斜视图。高质量,适当对齐的X射线照片可以测量前面提到的关键参数,这些参数预示着骨折的稳定性并有助于确定手术方法。这些包括桡高度,桡倾斜,桡倾斜,尺骨方差,关节一致性和远端桡骨尺骨关节稳定性[6,7]。 X射线照片可显示远端段的持续性骨折线,扇形或骨重吸收,以及松动或破损的硬件。手腕屈曲和伸展X光片可以通过显示骨折部位运动提供额外的益处。肥厚性,寡营养性和萎缩性放射照相外观允许临床医生在制定治疗计划之前对骨折稳定性的程度,感染的存在以及骨折碎片的生物活力进行推断。萎缩性骨不连的存在应引起对潜在感染过程的关注。此外,对侧腕关节的比较视图可以帮助进行术前计划。虽然射线照相参数可作为治疗的有用基准,但在确定治疗过程时应考虑每位患者的症状和功能。
高级成像的作用很难界定,应根据具体情况加以考虑。旋转畸形和关节一致性通常难以在平片上评估,计算机断层扫描(CT)可能是一种有用的辅助手段。三维重建图像提供关于关节位移和轴平面畸形的信息(图7.1)。 CT还有助于评估骨重吸收和骨质减少,这可能会影响固定方法。
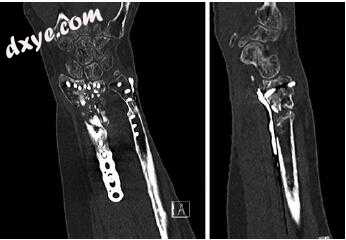
图7.1计算机断层扫描评估桡骨远端不愈合后固定和同种异体骨移植治疗粉碎性开放性骨折
7.2.5治疗
鉴于桡骨远端骨不连的罕见性,基于统计分析不可能提供治疗建议。相反,应该单独考虑每个患者,并根据骨折的个性,患者的需求以及是否存在感染来确定适当的治疗方案。非手术治疗通常仅适用于功能需求非常低的老年患者。从历史上看,最常见的不愈合治疗方法是腕关节融合术。然而,植入技术的进步,例如固定角度掌侧锁定板,改善了骨折愈合率。开放复位和内固定可能通过保持手腕运动对上肢功能产生显著的积极影响[1,14,15]。类似于骨折桡骨远端骨折,骨不连的患者经常会出现限制疼痛和不稳定的活动,大多数问题都是由骨折排列不齐引起的。在急性桡骨远端骨折的情况下,桡高度,桡倾斜,桡倾斜,尺骨方差和关节一致性的射线照相参数用于纠正不对中。这些相同的参数可用于治疗骨不连。治疗的目标应该是提供可接受的,稳定的骨折对齐,其中没有感染的软组织包膜和能够使骨折愈合的生物环境。
如本章前面所述,干骺端远端桡骨骨折愈合失败的情况很少见。在文献中没有明确定义桡骨远端延迟愈合和不愈合的定义。虽然损伤的严重程度在愈合速度中起着明显的作用,但人们可以预期在初始损伤后3个月内看到放射治疗的放射学证据。即使在具有广泛粉碎的骨折中,也可以预期4个月后愈合的证据。当在受伤或初始治疗后3至6个月的潜在不愈合期间缺乏进行性愈合时,持续固定和肢体废用可能对功能和运动范围产生不利影响。如果射线照片上出现不对称或萎缩性变化,进一步的保守治疗也无法解决主要问题。因此,作者建议在此期间内手术干预的门槛较低。
由于骨的骨质减少,骨折再吸收的潜在存在以及骨折固定的有限选择,对具有多个骨折碎片的非桡骨远端骨折的手术治疗具有挑战性。在先前的手术固定尝试失败后,大多数这些损伤将出现。在这种情况下,Fernandez,Ring和Jupiter概述的正交固定方法可以证明是有用的[1,16]。使用具有固定角度锁定板的双固定技术在远端节段中提供更多数量的固定点,并且在萎缩或骨质减少的骨骼的固定中提供更大的稳定性(图7.2)。使用这种技术,远端桡通过掌侧或组合的掌侧和背侧接近,取决于存在的畸形类型。 Chhabra等人提出的混合掌握方法。如果术前存在正中神经症状,或者如果实质性畸形矫正或软组织挛缩可能使术后正中神经处于危险状态,也可用于释放腕管[17]。确定骨折末端,去除纤维组织和滑膜,切除硬化或坏死骨。骨折的干骺端部分的每个末端的髓管被打开以促进血液和生长因子的骨内进入以促进骨折愈合。可能需要释放或延长肱桡肌和屈肌桡侧肌腱以矫正桡高度和倾斜度的损失。在内部固定之前,通常使用带有2.5 mm Schanz螺钉的外部固定器来帮助减少和保持对齐。应注意不要将Schanz销放置在可能干扰板固定的位置。克氏针用于稳定单个骨折碎片。使用Rikli和Regazzoni柱状分类,将一个平板放置在桡骨茎突和侧向桡上以控制侧柱,而将第二个平板放置在掌侧或背侧皮质上以稳定中间柱[8]。作者建议将更稳定的色谱柱初始固定到桡轴上,因为这可能有助于确定更复杂或粉碎色谱柱的排列。自体松质骨移植用于包装缺陷。骨折固定后,应评估桡骨远端关节的一致性和关节病。如果存在无法纠正的不对称或乙状切迹 - 左侧尺骨关节的预先关节炎变化,则可能需要诸如Darrach远端尺骨切除术或Bowers半切口插入关节成形术的抢救手术。
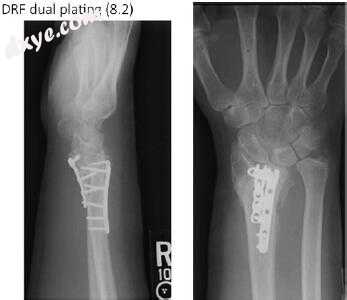
图7.2桡骨远端骨折的耳和背侧双固定
Ring和Jupiter报告了在这10年间使用这种技术治疗的总共23名患者[18]。在平均28个月的随访中,除了一个人之外,所有人都进入了成功的工会。一个持续性骨不连最终用手腕融合治疗。两名患者接受DRUJ抢救程序(Darrach或Bowers)治疗。根据费尔南德斯的评级系统,虽然患者的运动和功能范围明显改善,但他们从未恢复正常运动,只有23人中有7人有良好或优异的结果。在另一组10名患者中,Fernandez等人。报道了类似的结果[1]。所有10个成功治愈了他们的骨折。在4名患者中进行了远端尺骨挽救手术。平均腕关节屈曲为50°,腕关节伸直为55°,内旋和外旋为70°和75°。根据Fernandez功能结果系统,有3个优秀,4个好,2个公平,1个差的结果。
鉴于大多数桡骨远端骨折不愈合已经过以前的手术干预,在术前评估中应考虑不能充分解决骨折不稳定的模式。最常见的例子是未能识别和稳定掌侧尺骨角片段。虽然固定角度掌侧固定技术的进步已经全面改善了骨折固定并且允许更早的功能恢复,但是可能难以保持复杂的关节内骨折的复位,其具有远端桡骨的掌侧尺骨角或边缘骨折。掌侧尺骨角的稳定性对于为腕骨提供结构支撑是至关重要的,并且不能保持复位导致腕掌半脱位或脱位以及对腕部功能的灾难性影响[19-21]。 Medoff提出的片段特异性固定方法允许使用两个或更多个低剖面植入物来策略性地捕获特定的骨折碎片[10]。该技术可用于在骨质减少和骨折再吸收发生之前设定潜在的骨不连。只要不存在明显的干骺端粉碎,较新的固定角度,低剖面钩板可以使掌侧边缘更稳定地固定在骨质疏松骨中[22]。在显著的中隔粉碎或骨折重吸收的情况下,使用低剖面植入物是禁忌的,但骨折特异性固定的原则保持不变,并且掌侧尺骨碎片的控制对于稳定腕骨是至关重要的。
背侧牵引桥接固定是一种非常有用的技术,可用于骨折和骨质流失[23,24]。 Segelman和Clark [2]认为,如果月骨切面下方的软骨下骨少于5毫米,则可能无法结合,因为没有足够的空间可用于种植体固定。背侧牵引固定缓解了这个问题,并且可以矫正严重的桡缩短和骨质疏松性干骺端骨的桥接(图7.3)。在第二或第三掌骨上进行初始的4cm背切口,伸肌腱缩回。选择第二或第三掌骨是外科医生偏好的问题,并且可能受个体骨折特征的影响。 4厘米的第二背侧切口在远端桡骨上居中,在骨折粉碎水平附近至少4厘米。背板的荧光镜叠加可有助于板的选择和近端切口的定位。通常,使用12或14孔限制接触的动态压缩锁定板。对肱桡肌和第二背侧肌腱之间的近端切口进行钝性解剖,直到暴露背侧桡骨远端。应注意避免损伤从肱桡深处出现的浅表感觉神经。
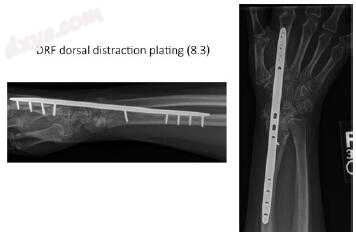
图7.3远端桡骨骨不连的背侧牵引(桥接)固定
如果选择第二掌骨,则将板放置在第二背侧隔室中,并且如果选择第三掌骨,则将板放置在第四隔室的肌腱深处。 游离或Cobb提升可用于产生从远端到近端切口的路径,并且板从远端滑动到近端,从而避免伸肌的撞击。将皮质螺钉置于远端板的中心孔中以使其稳定至掌骨。通过纵向牵引进行骨折复位以恢复长度,手相对于前臂的手掌平移以校正桡倾斜,以及手相对于桡的内旋以抵消腕骨的外旋。一旦确定减少,将第二皮质螺钉置于板的近端的中间孔中。其余的孔用锁紧螺钉填充。荧光检查和体格检查用于排除分散注意力。桡腕空间不应大于5 mm,应存在完全被动手指屈曲。补充固定,包括克氏针和片段特异性平板,可用于尝试改善对齐和关节一致性。 髂骨嵴自体骨移植物可用于填补缺陷。手术后,将患者置于短臂夹板中并立即开始指运动。在放射线照相骨折固结时移除该板,并开始腕部运动和渐进强化。
米塔尼等人。 [23]评估了总共8名接受这种技术治疗的患者,报告了所有患者的愈合情况,手术后平均移植了148天。患者报告运动范围和术前值的DASH评分有统计学意义上的显著改善。尽管愈合成功,但这种技术有一些潜在的并发症。必须指导患者将板固定5-6个月导致手腕活动范围的显著丧失,这需要坚持和延长的治疗才能恢复。另外,过度分散手腕可导致指挛缩,桡神经神经炎和复杂的区域疼痛综合征。最后,如果将板放置在导致肌腱截留的位置,则存在肌腱刺激甚至肌腱断裂的风险。
历史上推荐腕关节融合术作为桡骨远端骨折不愈合的一线治疗方法(图7.4)[16,17]。 然而,由于保持甚至最小的手腕运动范围导致上肢功能的显著改善,现在更常用作抢救手术。 当重建不可能或不推荐时,实现骨稳定性是有效的。 潜在适应症包括晚期桡腕骨或中睑退行性改变和广泛的骨丢失或重吸收。
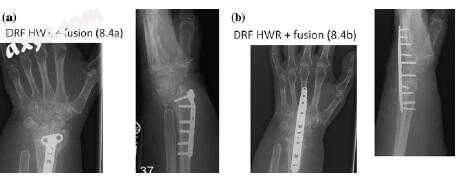
图7.4 a手掌固定后桡骨远端骨折的慢性不愈合。 b通过硬件移除和腕关节固定术治疗
在骨不连的情况下对感染的管理增加了额外的复杂性。对于怀疑感染,应保持较低的阈值,特别是在X光片上出现萎缩性畸形愈合。建议所有患者筛查白细胞计数,CRP和ESR。如果升高,CRP和ESR都可以独立预测感染,并且每次额外的阳性检测都会增加感染的可能性[25]。推荐使用放射性核素骨扫描作为感染的额外筛查工具,但它们不具有成本效益,并且在实验室阳性值设置中不会提高预测值[25]。可以获得来自骨不连部位的术中组织培养和任何相关的脓性,以提供确定的诊断并辅助抗生素治疗。没有文献可以指导是否可以通过单次手术治疗具有保留硬件的远端桡骨感染或需要分阶段治疗。在严重污染的情况下,在进行最终固定之前,建议根除感染。外固定器可用于矫正和保持对准,同时允许重复外科清创。治疗感染的桡骨远端骨不连应该被视为手外科医生和在整形外科感染护理方面经验丰富的传染病团队之间的合作。
自体松质骨移植用于改善生物学和填补由骨折重新调整产生的间隙。远端尺骨,鹰嘴和髂嵴都可以用作潜在的供体部位,这取决于所需的移植量。在大的节段性缺损的情况下,可以采集皮质髂嵴移植物,但供体部位发病率增加。还开发了骨移植替代物,包括骨形态蛋白,脱矿质骨基质和合成物,例如磷酸钙,硫酸钙和羟基磷灰石。虽然它们消除了供体部位发病率的风险,但所有这些都显著增加了成本,并且在骨折治疗中未被证实优于自体骨移植[26,27]。磷酸钙移植物具有骨传导潜力和高抗压强度,并且当与骨诱导物质组合以填充大的节段性缺陷时可能是有用的。
7.2.6术后护理
鉴于许多患者将具有显著的术前僵硬和畸形和长时间固定的功能障碍,应强调术后早期活动范围,手术后早晨开始指和前臂活动范围。患者在术后短臂夹板中固定10-14天。在此之后,可以放置可移除的夹板并开始康复,重点放在早期渐进的运动范围上。加强锻炼是受限制的,直到有放射学证据表明愈合,通常是手术后12周。随着更多的骨质流失,可以详细描述愈合情况。应该告诉患者这是一个在术前严重的僵硬,畸形和功能障碍的情况下的抢救程序,并且不太可能恢复全范围的运动和力量。
7.3桡尺远端关节不稳定
7.3.1背景
DRUJ是一种双向关节,充当桡骨和尺骨之间的远端稳定结构。它起枢轴点的作用,允许桡在旋后和旋前围绕尺骨旋转。赋予其稳定性的韧带结构可以在类似于产生远端桡骨骨折的机制中受伤。这通常包括具有腕关节内翻和伸展的轴向负荷,例如伸展在伸展的手腕上。因此,DRUJ不稳定可能发生在孤立或桡骨远端骨折的设置[28]。
慢性不稳定可以发生于尺骨茎突基部的非骨折性骨折或TFCC和DRUJ关节囊的纯韧带损伤。在后一种情况下,不稳定性可被视为DRUJ的软组织“不愈合”的结果。考虑到DRUJ不稳定伴有桡骨远端骨折的频率,在一项研究中高达11%,远端桡骨骨不连和畸形愈合的管理应该包括对该损伤的评估和管理的清楚理解[29]。
7.3.2解剖学和生物力学
通过乙状切迹的远端桡与尺骨头之间的关节包围DRUJ的骨结构。这种关系的相对不对称性导致最小的赋予稳定性。乙状切迹明显比尺骨头浅,曲率桡大50-100%(15-19 mm对10 mm)[28,30]。鉴于尺骨与尺骨头的不匹配,乙状切迹的掌侧和背侧边缘必须有助于稳定性。任何一个边缘的创伤后缺陷导致生物力学测试中关节稳定性降低[28,31-34]。背侧缘具有急性角度,而掌侧缘则是圆形的纤维软骨唇[28]。 DRUJ关节面的冠状和轴向对齐之间存在显著差异。在冠状平面中,关节呈现相对于桡骨和尺骨的长轴的三个斜面中的一个:平行,倾斜或反向倾斜[33]。虽然在基线时,形状对稳定性或功能没有影响,但是桡或尺骨的相对长度的变化可能导致关节表面之间的不匹配和增加的接触压力。例如,患有反向倾斜构型的患者的尺骨缩短截骨术可导致近端尺骨头和乙状切迹的负荷和增加的接触压力[35]。
在轴向或横向平面中,乙状切迹有4种可能的配置:平面,滑雪坡,C型和S型。扁平凹口形状具有最小的固有稳定性,并且在尸体模型中单独进行软组织重建更容易发生故障[36]。尺骨头是DRUJ关节的稳定单元,作为桡旋转的平台。与乙状切迹相比,尺骨头关节面的轮廓通常略微不对称,这可导致前臂旋转的CAM效应,并进一步传播不稳定伴韧带损伤[28]。这些解剖学因素的最终结果是尺骨头和乙状切迹关节提供的DRUJ约束仅有20%,其中大部分稳定性由软组织附着所贡献,包括TFCC [32]。
与TFCC一起,DRUJ囊,旋前肌,尺侧腕伸肌和骨间肌膜都有助于DRUJ的稳定性。 TFCC的组件在提供稳定性和维持DRUJ运动学方面是最重要的[30,37]。 TFCC由几个提供不同功能的汇合结构组成。它们包括延伸桡的关节面以覆盖尺骨头,吸收和传递轴向负荷力,连接桡骨远端和尺骨,以及支撑尺骨腕[28]。 TFCC的组成部分是掌侧和背侧桡尺韧带,掌侧和背侧背侧韧带,关节盘,半月板同系物和伸肌腱尺腱鞘[28,37]。桡尺韧带为DRUJ提供主要稳定力,对于掌侧和背侧平移的正常稳定性是必需的。尸体研究表明,在其他软组织稳定剂分裂后,它们维持正常的DRUJ关节运动学[38]。起源于乙状切迹的掌侧和背侧,每条韧带在横跨尺骨延伸时分为冠状平面中的两个肢体。深桡骨韧带位于两侧较近端,因为它附着于中央凹,在尺骨茎突基部的浅凹,裸露的软骨和含有供给TFCC的血管。浅表的肢体向远端延伸,插入尺骨茎突的中部[39]。韧带的不同附着点对尺骨茎突骨折的稳定性产生影响。茎突基部的骨折通常表明DRUJ从中央凹的深部分离中不稳定[28]。
虽然两个韧带都必须存在以防止任一方向的平移[28,32,40],但是桡尺韧带提供稳定性的确切机制仍然存在争议。在一种提出的机制中,背侧桡尺韧带作为尺骨背侧脱位伴有内旋的主要约束,而掌侧韧带则在旋后相对于掌侧逃脱。这是由一项尸体研究支持测量旋转极端的韧带应变[40-42]。另一种理论恰恰相反,是通过应用平移力观察骨移位而得出的。在这种情况下,掌侧韧带与内旋和背侧韧带背侧移位相反,通过束缚效应抵抗旋后移位; [32,43]。这两种理论对临床管理几乎没有影响,除了强化韧带发挥协同作用的观点,并且在双向或严重的单向不稳定性允许关节脱位的情况下应该预期对两条韧带的损伤[28,40]。
TFCC的关节盘由纤维软骨组成,纤维软骨从远端桡骨的关节边缘延伸,直到与深的掌侧和背侧桡骨韧带混合。它的主要功能是承受和传输DRUJ上的压缩载荷,并为DRUJ转换提供最小的稳定性[41,44]。深桡骨韧带通过防止压缩力张开来加强椎间盘[35]。
ECU腱鞘从背侧尺骨头到腕骨。它不仅可以稳定ECU肌腱,还可以增强背侧DRUJ关节囊。 TFCC的掌侧部分还包含三个尺骨韧带,这些韧带以它们插入的腕骨命名。这些是尺三角,尺月和尺头韧带。尺三角和尺月韧带起源于掌侧放射性韧带,而尺头韧带更多掌侧并且起源于中央凹。他们理论上提供了对尺骨平移和旋转的约束,尽管它们对DRUJ稳定性的贡献是未知的[28]。半月板同源物以松散的结缔组织命名,其占据关节囊,椎间盘和三角骨近端表面之间的空间,并提供未知功能[28]。
7.3.3临床评估
DRUJ的软组织稳定剂的能力不足在临床上表现为疼痛,握力降低和机械症状[39]。与任何初步评估一样,它应首先详细记录患者的损伤机制和未遂治疗。应获得疼痛和不稳定的位置,质量,严重程度和频率,以及缓解或加重症状的任何因素。患者通常会描述在伸展的手腕上跌倒或被动强力手腕旋转的历史,例如使用卡住的电动工具[28]。由于前臂旋转而加重的初期尺侧腕关节疼痛可能随着时间的推移演变成限制疼痛,虚弱和机械症状的活动。具有更严重不稳定性的患者可能描述出可触及的前臂旋转活动,例如转动螺丝刀[28]。
鉴于桡腕关节,尺骨腕,月三角和近端桡尺关节损伤可引起类似症状,需要对肘关节远端的受累肢体进行全面检查。检查者应首先检查DRUJ,腕关节和前臂,评估尺侧头部与对侧相比的肿胀或突出。在骨折不愈合的情况下,可以发生尺骨茎突触诊的柔软性。位于尺侧腕屈肌,尺骨茎突和三角肌之间的软凹陷处的中央凹的柔软性可指示TFCC损伤。应测量两肢的主动和被动运动范围,包括手腕运动和前旋,以进行比较。应注意显著的痉挛或减少和疼痛的运动,因为这可能表明DRUJ关节炎,这将是软组织重建手术的禁忌症[45]。进行去壳测试以评估稳定性。用一只手抓住远端尺骨,而另一只手稳定远端桡。然后将尺骨在掌侧和背侧强力平移。与对侧相比疼痛或转移增加表明DRUJ损伤。转移可能因前臂旋转而异,因此应在旋后,旋前和中立位置重复测试[28,45]。
应进行Ulnocarpal关节压力测试以评估TFCC盘撕裂和症状性尺桡肌嵌顿综合征。通过压力测试存在疼痛,其中患者通过使用他或她的手臂从坐着向上推立位置来轴向加载手腕,这表明TFCC撕裂[45]。该测试还可以提供DRUJ不稳定性的信息。试图从椅子上向上按压,尺骨头在受影响的一侧会显得更加下陷。在腕部轴向负荷尺度偏差的同时,手腕通过一系列运动(屈曲 - 伸展和/或旋前 - 旋后)的动作也可用于引发TFCC和尺神经病理[28]。
ECU半脱位和肌腱炎和月三角韧带撕裂都会导致类似DRUJ损伤的症状。 ECU的不稳定性可以通过“冰淇淋勺”测试引起,其中手腕从旋前和桡偏离的位置旋转到旋后和尺骨偏离。
可以使用LT剪切试验检查月三角韧带损伤。月骨在检查者的食指和拇指之间稳定,而另一只手向三角肌提供一个背侧翻转力。阳性测试表现为疼痛[28]。
7.3.4成像
初步射线照相评估应包括标准PA和侧视图。双边图像可用于比较,应注意确保正确定位以获得对称视图。旋转的轻微变化可以对射线照相参数的测量产生显著影响。使用PA视图最好测量尺骨方差,尽管远端桡骨和尺骨之间的静息,特别是当对侧肢体的图像上不存在时,可以指示DRUJ不稳定。有时,从中央凹射出一小块骨头,表明深桡骨韧带脱离[28]。对于有腕关节嵌顿综合征症状的患者,前臂内翻PA或握紧拳头视图有助于评估动态尺骨阳性方差[46-48]。精确侧视图的目标是使穗状体将舟状骨远端的掌侧表面和头状(scaphopisocapitate侧视图)一分为二[28]。
虽然通常用于评估DRUJ不稳定性,但它是不精确的,因为半脱位的尺骨可能看起来减少,并且脱位的尺骨可能出现半脱位,仅有10°的前臂旋转[49]。可以通过侧向应力观察进一步评估疑似不稳定性,患者在旋前位置保持5磅重量[50]。半旋前和半旋后视图允许可视化乙状切迹和尺骨头,以评估骨折,不一致,早期退行性变化和骨赘形成[28]。射线照片还应用于评估桡骨远端骨折,这可能是DRUJ不稳定的根源。
计算机断层扫描可以是一个有用的工具,因为它既可以评估远端桡尺关节的一致性,也可以评估晚期退行性改变,这将禁止软组织重建。对于症状轻微不稳定的患者,它最有用[28]。为了完全比较,两个手腕应该在相同的前臂位置成像,包括中性,旋前和旋后[28]。测量方法利用轴向图像。这些包括背侧和掌侧的尺桡骨线,一致性方法,震中方法和尺桡骨比[49,51,52]。大量研究表明所有方法的研究结果都存在差异。因此,大多数作者建议结合多种测量,同时继续最依赖于患者检查和临床病史[28]。
由于其能够提供软组织结构的详细图像,MRI是用于评估急性环境中TFCC撕裂的主要先进成像模式。关节镜检查仍然是诊断TFCC损伤的金标准,但MRI的敏感性和特异性仍在不断提高[28,53]。在亚急性或慢性环境中,MRI的使用不太明确。尽管尚未进行正式测试,但MRI可用于评估TFCC的衰减,并导致无法在初始损伤发生数周或数月的患者中进行初次修复。
7.4治疗
7.4.1急性桡尺远端关节不稳定
对DRUJ急性不稳定的治疗大大超出了关于手腕和手不愈合的章节的范围,但为了完整起见而提到。急性DRUJ不稳定的最常见原因是桡骨远端骨折。在准确的骨折复位和稳定后,这些损伤中的大多数将是稳定的。在治疗桡骨远端骨折后,应在整个旋前和旋后范围内重新评估稳定性。如果仅在完全旋前或旋后保持稳定性,则应将DRUJ固定在该位置。通常,背侧脱位在旋后稳定,而掌侧脱位在旋前稳定[28]。如果不稳定性持续存在,则表明TFCC的开放式修复(本章稍后将详细讨论)。
7.4.2慢性桡尺远端关节不稳定
任何治疗DRUJ不稳定的目标应该是恢复稳定性和完全无痛的运动范围。虽然不清楚DRUJ不稳定是否使患者易患关节炎,但如果没有手术治疗,慢性不稳定症状很少会改善[28]。已提出功能性支撑,其显示有效减少半脱位和改善运动范围[54]。这可能是需求较低的患者的考虑因素。手术治疗选择包括由尺骨茎突不愈合引起的不稳定性的手术固定,TFCC的直接修复或软组织重建。在慢性不稳定的情况下,TFCC经常无法修复,并且指出了软组织重建技术[39]。不太直接的是亚急性损伤的治疗或微妙的不稳定性,其中软组织衰减不太明显。
尺骨茎突骨折是桡骨远端骨折的常见发现,发生率为61%[55]。如前所述,茎突尖端的骨折通常保持DRUJ的稳定性,因为深掌侧和背侧桡骨韧带保持完整[28,56]。茎突基部的骨折可能涉及深韧带和浅韧带,导致DRUJ不稳定,特别是在显著的骨折移位[28,29,57]。尺骨茎突骨折不愈合通常无症状。如果DRUJ稳定,可以切除疼痛的尖端骨折而不影响稳定性[29,57]。在大片段和稳定DRUJ的情况下,应谨慎切除症状性片段(图7.5)。应重新评估稳定性,如果DRUJ变得不稳定,应使用骨间肌缝合线将TFCC修复至茎突的中央凹[57]。在DRUJ不稳定的情况下,可以尝试固定茎突骨折。已经描述了许多技术,包括克氏针,压缩螺钉,微型碎片,张力带布线和缝合锚[28]。选择的植入物取决于外科医生偏好和片段大小的组合。在片段固定后应重新评估DRUJ稳定性,如果不稳定持续,则需要软组织重建程序。
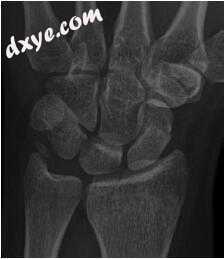
图7.5无症状的慢性尺骨茎突不愈合
关于孤立的软组织损伤,TFCC的尺骨侧附着物的撕裂最常与DRUJ的不稳定性相关。虽然TFCC的撕裂在远端桡骨骨折的设置中很常见,但大多数不会引起急性TFCC不稳定,如果在受伤时得到充分解决则不会进展[28]。已经描述了关节镜和开放修复技术用于修复导致DRUJ不稳定的TFCC损伤。在慢性DRUJ不稳定的情况下关节镜TFCC修复的适应症尚未完全描述,并且担心单独的软组织修复可能不会赋予足够的稳定性。较新的关节镜技术,如推动锁定器,有助于通过尺骨中的钻孔将TFCC直接修复到中央凹,可能是有益的,但在这种情况下还没有得到充分的研究。如Adams [28]所述,通过第五和第六伸肌室之间的DRUJ背侧入路进行开放修复。伸肌数字迷你肌腱操作并缩回。然后在背侧囊中进行L形囊切开术,切口的纵向部分在尺骨颈的桡方向上居中,并且横向肢体开始于背侧尺桡骨韧带的近侧。随着囊切开术的收缩,TFCC可以被可视化。
如果适于修复,则在背尺骨桡骨韧带的远端进行第二横向囊切口以使泪液可视化。缝合线以水平或垂直床垫构型穿过撕裂的外围边缘和相邻的关节囊。使用克氏针或小口径钻头将尺寸放置在尺骨中,便于直接修复撕裂至中央凹的骨骼。缝线穿过装置在使缝合线穿过骨隧道方面是有价值的。然后将缝合线绑在骨上,在中性前臂旋转中缩小尺骨。背侧囊和伸肌支持带闭合在一个单层,不包括最小伸长的伸肌腱,这是闭合的表面。完成此案后,应恢复DRUJ稳定性。如果不是,应考虑使用软组织重建进行增强。
在不可修复的TFCC损伤的情况下指示软组织重建程序。已经描述了许多外科技术,其可以通过尺骨固定术或尺骨腕吊带和尺桡骨韧带的关节内重建分为桡骨和尺骨的关节外连接类别。 Adams和Petersen在尸体模型中研究了间接重建技术,但未能恢复原生DRUJ稳定性或运动学[58]。然而,当不再可能进行解剖重建时,它们可能在先前尺骨头切除的设置中是必要的。其中包括Boyes和Bunnell提出的技术,以及Hui和Linscheid利用屈肌腱(FCU)肌腱带重建掌侧尺骨韧带[59,60]。这两种技术引起了对DRUJ长期稳定性的关注,因为掌侧韧带韧带对DRUJ稳定性的贡献未知。肌腱的束缚效应还存在运动丧失的风险[39]。
在Scheker等人的技术中已经描述了一种或两种尺桡骨韧带的尝试解剖学重建。 [50],Johnston等人。 [61],以及亚当斯和伯格[31]。在Scheker等人的技术中,使用肌腱移植物仅重建背尺骨桡骨韧带。这引起了对构建体长期稳定性的关注,因为尸体模型已证明两条韧带必须因不稳定而破裂[62]。尽管如此,他们报告说,所有14例接受手术治疗的患者对其结果都表示满意,没有复发性不稳定,握力增强,疼痛接近完全消退,平均随访1。5年[50]。 Johnston等人提出的技术。 Adams和Berger试图用自体掌状长肌重建掌侧和背侧尺桡骨韧带[31,61]。两人都报告了类似的中期结果。约翰斯顿等人。 [61]报道了14名患者中的13名患者满意的结果,所有患者的运动范围至少为未患病侧的90%。 Adams和Berger报告说,患者恢复了约85%的握力和对侧手腕运动[31]。在这两项研究中,14名患者中有12名能够恢复到之前的就业水平[31,61]。
与开放性治疗TFCC损伤类似,Adams和Berger描述的技术利用第五和第六伸肌室之间的DRUJ背侧入路[28,39]。伸肌支持带纵向分开以便以后修复,EDM肌腱操作并缩回。进行背侧L形囊切开术,应注意不要违反ECU护套。背侧尺骨远端桡骨的骨膜升高,深至第四伸肌室。根据掌长移植物的大小,使用3.2-4 mm空心钻头系统在距离背部到掌侧的远端桡中放置一个隧道,位于月骨窝近端5 mm处,距离月球窝5 mm处。乙状切迹。使用相同的空心钻在尺骨颈部开始在尺骨中放置第二个隧道并从中央凹处离开。 C臂透视检查对于在钻孔之前确认导丝的位置是有价值的。在移植物的每个末端放置一个锁缝,然后使用缝线穿引器通过桡骨和尺骨编织移植物。移植物的剩余肢体绕过尺骨颈的皮下边缘并且在尺骨缩小并且前臂处于中性旋转的情况下系在一起。应注意确保尺神经的分支被包埋在构建体中。另外,如果移植物穿过尺骨隧道后长度不足以穿过尺骨,可以使用生物复合干涉螺钉来稳定尺骨隧道内的移植物[28]。背侧囊切开术和伸肌支持带闭合在一层,EDM肌腱留在囊闭合的表面。
对于乙状切迹平面对齐或乙状切迹边缘骨折的患者,骨整形术可视为隔离或补充手术,以防止尺骨远端背侧半脱位[28] 。轴向计算机断层扫描图像可用于评估凹口对齐和畸形[28]。 Wallwork和Bain提出的程序可以与TFCC韧带的重建相结合[63,64]。远端桡通过DRUJ的背侧进入。骨凿用于在远端桡骨背侧尺骨角处进行2个平行的横向截骨术,一个刚好靠近软骨下表面,第二个位于乙状切迹的近端边缘。然后进行第三次纵向切割,连接距离乙状切迹5mm的平行截骨术。这产生了一个薄的骨软骨瓣,可以从远端桡骨回填松质骨移植物。到目前为止,只有一个案例报告和一篇技术文章已经发表在这个主题上。临床试验有助于确定长期结果。
7.4.2.1术后管理
在软组织重建之后,患者在中性前臂旋转中被固定在长的夹板中3周。在3周时,夹板被移除并且它们被转换成短臂铸造并且允许有限的前臂旋转另外3周。然后将患者转换为可移除的腕托,再使用2个月。治疗是通过主动和温和的被动腕关节屈曲,伸展,旋前和旋后开始的。早期开始加强,小心翼翼地避免手臂完全内旋和旋后的高力。更具侵略性的被动运动和加强范围被推迟到4个月大关,目标是将原先前臂旋转的85%恢复6个月。返回活动并且提升超过5磅被延迟至手术后至少4个月[28,31]。
7.5腕骨
7.5.1舟状骨
7.5.1.1背景
舟状骨是腕骨中最常见的骨折骨,占所有腕骨骨折的60%至70%[65]。骨折最常影响年轻,活跃的男性患者群体。在一项针对美国军人的研究中,发病率为每10万人年121人,骨折最常见于21-24岁的男性[66]。实现联合是至关重要的,因为骨折无法治愈可预测的残疾模式,腕骨塌陷和最终的桡腕关节病。这些损伤的愈合是一个复杂的过程,受到骨折位置和方向,位移和舟状骨血管供应的影响。由于腕骨骨骼之间的韧带连接,愈合舟状骨骨折受到显著的剪切和弯曲力[65]。尽管如此,涉及舟状体和远端体的非移位或微小移位的骨折可以通过铸造中的刚性固定来治疗,预期的联合率报告大于90%[67]。延迟诊断,骨折移位大于1 mm,角度大于15°,近端骨折位置和X线片上的骨坏死证据代表骨不连的危险因素,通常用作手术治疗的适应症。一些荟萃分析报告了急性手术治疗后的愈合率,接近100%[68-72]。因此,正确初步评估和管理这些骨折至关重要。当骨折未能按预期愈合或以延迟的方式出现时,对非单位舟状骨的护理可能具有挑战性。对舟状骨的延迟愈合或不愈合的正确方法是手专家之间持续研究和争论的主题,将在本节中讨论。
7.5.1.2解剖学和生物力学
腕骨的骨骼在两个匹配的行中排列,由内在韧带和复杂的掌侧和背外外韧带系统支撑。舟状骨具有复杂的三维解剖结构,与花生非常相似,关节软骨覆盖其表面的80%。它是桥接两个腕骨行的唯一腕骨。骨被分成三个解剖区域:近端,腰部或身体,以及远端或结节。近端关节与远端桡骨和月骨的舟状窝连接,而远端关节形成肩胛骨 - 梯形 - 梯形关节。近端的骨骼是最密集的,因为它从远端桡传递穿过腕骨的轴向载荷。相比之下,腰部的骨骼密度最低,这可以解释为什么大多数骨折发生在这个区域[73,74]。形态学评估表明,雄性scaphoids比雌性scaphoids长,这可能会影响螺钉长度与手术固定[73]。
由于舟状骨几乎完全被关节软骨覆盖,因此穿刺血管进入的空间最小。这种独特的解剖结构导致血液供应复杂。由Gelberman等人进行的尸体研究。确定通过桡动脉的分支进入大约80%的血流,该分支进入舟骨腰部的背脊并以逆行方式供应近端杆。剩余的20%由进入远端杆的另外的掌侧桡分支供应。近端的微弱血液供应导致舟骨腰部或近端骨折后不愈合和缺血性坏死的独特易感性[75]。
舟状骨骨折发生的确切机制尚未明确阐明,尽管它似乎是轴向负荷与腕关节过度伸展或不太常见的腕关节屈曲的组合[76,77]。如前所述,愈合潜力取决于许多因素,包括位置,位移,角度和血管分布[28]。膜内骨化是舟状骨骨折愈合的机制。由此导致的保护性愈伤组织形成的缺乏使得舟骨在整个愈合过程中易受机械力的影响。如果没有提供适当的固定或稳定,这可能导致骨折移位或角度。舟状腰部骨折暴露于弯曲,剪切和平移力的组合。在骨折愈合之前施加到手腕的轴向载荷将导致远端杆的渐进性屈曲和内旋。随着时间的推移,远端极将继续成角,因为掌侧骨被重新吸收,导致“驼背畸形”。近端骨折的血液供应有限,这进一步加剧了这种情况。骨折移位,角度和缺乏血液供应的组合都有助于骨不连和最终缺血性坏死的发展[28]。
如果不及时治疗,舟状骨不连导致桡腕和中腕关节内可退行性关节炎的可预测模式,称为舟骨骨不连进退缩(SNAC)。舟状骨是近端和远端腕骨行之间的重要连接。结果,舟状骨不连导致腕骨力学的显著破坏。在正常的手腕中,舟状骨和月骨通过舟月骨骨间肌韧带相连,其将月骨拉入弯曲位置,舟状腕与腕部桡偏离。驼背畸形中远端杆的掌侧塌陷导致腕骨高度降低。随着桡偏离,月骨继续随着舟状骨的近端极延伸,而远端极保持在弯曲位置。随着时间的推移,所得到的背侧中间体或嵌体不稳定性(DISI)模式变得固定,并且退行性变化的进展类似于在舟月骨韧带缺损手腕中观察到的变化。退行性变化开始于桡骨茎突与舟状突关节,然后扩散到整个桡舟,放射性关节和舟头关节,并以颅底关节炎结束。患者最初可能无症状,但最终会发展为与进行性活动相关的疼痛。在一项研究中,97%具有至少5年舟状骨不连病史的患者在X线片上显示出退行性改变[78]。
7.5.1.3临床评估
已知或预期的舟状骨不连的患者的评估应从详细的病史开始。大多数患者经常会出现疼痛,僵硬或无法恢复正常活动超出人们对骨折愈合期望的时间,而一部分患者将保持无症状。尽管可能很困难,但应该尝试获得伤害。偶尔,患者将无法回忆特定事件,而是功能减退,疼痛发作或运动丧失。应审查临床记录以确定任何先前的治疗。在封闭管理的情况下,应获得固定使用的持续时间和类型。对于接受手术治疗的患者,所使用的固定方法和类型有利于以后的术前计划。虽然这些患者中的大多数都是年轻且活跃的,但应该获得完整的病史。应特别注意使用烟草制品。虽然不是手术的绝对禁忌症,但它们的使用是骨不连的危险因素,应该为患者提供戒烟咨询并提供帮助[79,80]。
身体检查应尝试尽可能温和地定位疼痛源。应获得手腕活动范围并与对侧进行比较。虽然疼痛并不总是局限于解剖鼻烟窝区域或舟状骨的任一极,但是弥漫性疼痛和显著减少的运动范围应该提醒检查者有可能进行晚期退行性改变。
放射照相评估的目标应该是确定骨折的愈合程度,排列和血管分布,以及任何退行性变化的证据。初始X光片应包括标准的后前位,外侧,45度旋前倾斜和舟骨(腕部尺骨偏离中的PA)视图。它们可能显示硬化,囊肿形成,骨重吸收,骨折移位或角度,或硬件松动或失败。侧位X线片也可用于评估DISI畸形,舟月角> 60°或放射性角> 30°[81,82]。如果存在,它会影响术前计划,因为对舟状骨的对齐和正常舟月关系的校正可能具有挑战性[83]。应检查所有先前的X光片,包括初始损伤片,以确定愈合的进展和任何进行性骨折移位或角度的证据。
计算机断层扫描(CT)扫描提供了骨骼解剖结构的最详细图像,可用于确定模棱两可的X射线照片设置中的不愈合。 CT在确定位移和骨折愈合方面表现出很高的观察者内可靠性(图7.6)[84]。 CT还可以提供有关塌陷后骨重吸收的有价值信息以及退行性变化的早期证据。 CT图像用于确定舟状骨的角度与矢状位图像上的横向骨内角度或高度 - 长度比[84]。为了准确,CT应垂直于舟状骨的长轴而不是手腕[85]。正常的侧内骨关节角度为24°,而大于45°的角度可预测关节炎的风险增加,即使在愈合的骨折中也是如此[86]。尽管高度 - 长度比已证明观察者内部可靠性高于椎体内角度,但其临床意义尚不清楚。舟骨塌陷被认为是显著的,高度与长度之比大于0.65 [87,88]。 CT还可以评估技术错误,例如螺钉错位和不充分的骨折复位和压缩。具有金属抑制的当前CT协议可用于最小化硬件伪像。虽然没有MRI那么有效,但CT可以通过增加近端的放射不透性和骨折碎片之间缺乏桥接小梁来预测近端骨坏死[85,89]。
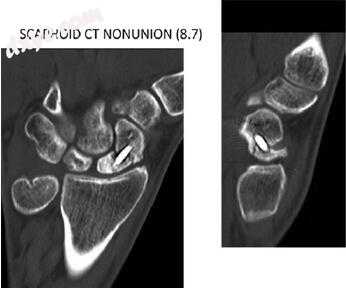
图7.6计算机断层扫描显示先前用螺钉固定治疗的舟状骨骨折骨折不愈合
由于X线片预测骨坏死的不可靠性,MRI在舟状骨骨不连的术前评估中起关键作用。研究已经确定MRI是确定近端血管的最有效的成像方式(图7.7)[90-93]。它还可以有效地诊断隐匿性舟状骨骨折并确定接受过手术治疗的患者的血管化骨的程度[83]。 T1和T2重量图像信号强度的降低或缺失与血管供应受损有关[93]。在未接受血管化骨移植治疗的患者中,术前MRI发现的患者愈合率不理想[93]。此外,一项临床研究直接将MRI信号缺失与骨坏死,空骨缺损和术中骨活检标本内骨扫描摄取不良相关联[93]。虽然如果X线平片明确显示骨坏死,MRI是不必要的,建议完全评估任何腰部或近端骨折中骨坏死的存在,并确定骨不连。
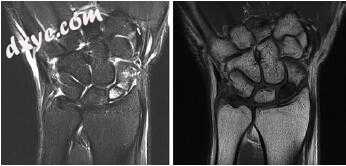
图7.7舟状骨骨不连的磁共振图像,t1和t2信号变化与近端远端无血管坏死一致
7.5.1.4治疗
手术治疗表现为骨不连,因为自发愈合非常罕见[94]。一旦确定骨不连的诊断,用骨刺激器添加石膏固定和/或脉冲电磁场​​治疗不会导致可预测的巩固[95]。在非移位骨不连中使用铸造和骨刺激器,没有骨坏死的影像学证据,愈合率仅为69%[95]。
延迟联合代表一种断裂类型,值得个别讨论。虽然对延迟愈合没有明确的定义,但是当X光片无法证明预期的愈合进展时应该考虑。对腰部或远端的非移位骨折进行初步保守治疗是一种合理的方法。然而,当X射线照片在固定6-8周后未能显示出愈合迹象时,应该强烈考虑手术干预,当然还需要12周。由于缺乏愈伤组织沉积,愈合的确定可能是困难的,并且CT扫描可能是确定性评估所必需的。这在运操作和年轻劳动者中尤为谨慎,因为研究表明,早期手术干预可以更快地恢复比赛和工作,降低整体医疗费用[96,97]。此外,长时间的长臂固定可导致肘部和腕部僵硬,对功能和生活质量产生负面影响。此外,在没有骨再吸收,塌陷或骨坏死的情况下对延迟愈合的管理在技术上要求较低,并且可以通过压缩螺钉实现而无需骨移植。无论是初始患者呈现是急性还是延迟,骨折移位大于1 mm,骨折粉碎,近端骨折,骨折角度表现为大于45°的椎体内角度或高度与长度比大于0.65,以及差患者依从性均代表最终非患者或畸形愈合的预测因素,并且需要立即进行手术治疗[86,87,98]。
在已建立的骨不连的情况下,大多数作者建议采用骨移植进行切开复位内固定(图7.8)[98-102]。在整个手术稳定的发展过程中,已经使用了许多植入物,包括克氏针,钉,板和压紧螺钉。选择的植入物必须能够承受剪切力并破坏骨折愈合。克氏针缺乏维持骨折复位所需的抗压强度,而钉和钢板的使用虽然在急性骨折中表现出令人满意的愈合率,但却引起了对硬件撞击和周围关节软骨损伤的担忧,并且往往需要在以后拆除硬件[103,104] ]。新的迷你平板技术可以减轻这些问题中的一些,同时理论上提供了与螺钉相比增加的扭转稳定性[105,106]。尽管如此,压迫螺钉仍然是目前治疗急性舟状骨骨折和骨不连的主要方法。赫伯特开发了最初的无头螺钉。即使没有压缩设计,他们报告急性骨折的愈合率为100%,总体为83%[107]。随后的进展表明通过部分螺纹或全螺纹,可变间距设计增加了压缩。在荧光镜引导下使用导丝放置的插管系统的添加提高了螺钉放置的准确性。研究表明,精确的螺钉定位是至关重要的,其中最大的稳定性是由位于PA上的骨中心位置和侧视图或垂直于骨折线[108,109]的螺钉所赋予的。此外,Trumble等人的研究。据报道,在近端中央三分之一处的螺钉置入减少了50%的时间[81,109,110]。现在有几家公司开发了压缩螺钉,比较它们的有效性的数据很少。
因此,螺钉选择在很大程度上取决于外科医生的偏好。
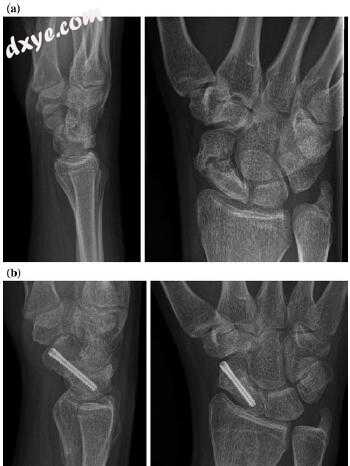
图7.8肩胛骨腰椎骨折的慢性不愈合,无近端股骨头缺血性坏死。 b图像术后10周显示掌侧非血管化骨移植和加压螺钉固定后愈合骨折
植入物选择后,治疗算法的下一步是手术入路和骨移植材料的选择。骨折稳定性和排列,骨重吸收,骨坏死的存在以及先前的外科手术干预的组合用于确定手术入路和骨移植源。
7.5.2没有骨坏死的舟骨骨不连
良好排列,稳定的骨不连,伴有大量骨质流失或骨坏死的证据代表了一类骨折,其中对术中骨移植的需求仍存在争议。 Shah和Jones的一项研究发现,具有稳定纤维骨不连或完整软骨帽的骨折愈合,无需植骨[111]。 Slade等人的其他研究。和Ikeda等人。结果显示,如果CT扫描时硬化小于1-2 mm,则单独使用螺钉固定治疗所有骨不连的愈合情况。值得注意的是,在初始损伤后6个月内治疗的骨折愈合速度比老年损伤更快[112,113]。骨折位置确定手术入路,大多数作者建议采用掌侧方法治疗腰部骨折,以保留剩余的背部血供和近端骨折的背侧入路,这样可以改善进入并降低使用导丝放置移位近端杆的风险[36,65,83]。
充分灌注但骨质流失严重的骨折需要使用骨自体移植物来提供结构稳定性并增强愈合潜力。松质骨与皮质结节移植物的选择仍然存在争议。 Geissler,Slade和Gillon认为,关节镜引导经皮固定,骨移植足以治愈非移位或微小移位的骨折,骨折部位纤维稳定[65,114]。在他们的技术中,使用骨活检针从远端桡骨或髂嵴采集松质骨自体移植物。然后使用经皮小切口背侧方法将导丝置于舟状骨内。将第二根线放置为抗旋转线,并进行关节镜检查以确认纤维性骨不连的存在,评估血管分布,并排除韧带损伤。在关节镜可视化下,使用弯曲的止血钳通过3,4门进行背侧囊膜释放。然后移除关节镜,并且为压缩螺钉钻出舟状骨。将导丝留在原位,并将骨活检针置于其上以递送骨移植物。最后,放置比测量的舟状骨长度短4mm的压紧螺钉。使用这种技术治疗108例舟状骨骨折不愈合,无移位或可减少的驼背畸形,Slade和Gillon报告在9个月时愈合率为96%。 10例延迟愈合需要重复经皮骨移植[114]。经皮骨移植也可以通过有限的掌侧方法,在非移位的骨折不愈合的情况下进行。使用这种技术,只有在掌侧方法暴露的角骨关节。去除多角的掌侧喙以允许移植和逆行螺钉放置[36]。
其他作者认为结构稳定性需要皮质纤维移植物,并且只有开放式方法才能完全排出硬化骨,这可以防止愈合。通过开放治疗血管良好的骨不连,骨折的位置仍然是手术方法的主要决定因素。 Russe描述的掌侧方法有助于进入舟状骨的腰部和远端,同时保持背部血液供应,特别是在纤维性骨不连或完整的背侧皮质[36]。标准的Russe切口开始于在屈肌桡侧(FCR)肌腱上方的近侧纵向切口,然后倾斜角度与舟状骨的长入口一致到肩胛骨关节的水平。 FCR肌腱鞘被切开以允许肌腱的尺骨收缩和保护正中神经的手掌皮肤分支。注意保护桡收缩的桡动脉深支。倾斜切开掌侧桡腕韧带以允许进入舟状骨并随后修复韧带。保留尽可能多的RSC韧带可防止舟状近端的掌侧半脱位[81,110]。
Matti-Russe程序描述了通过掌侧方法进行的皮质囊肿移植术,特别适用于骨折移位最小,骨缺损较大,无驼背畸形[115]。
去除骨不连部位的任何纤维组织,并使用骨凿暴露骨折线。然后使用骨切片或高速毛刺切割皮质窗口,去除一条皮质骨,并创建用于移植物放置的槽。从近端碎片切除所有坏死骨,点状出血是血管保留的标志。如有必要,减少舟状骨。克氏针可以作为操纵杆放置在每个碎片中,以帮助减少。然后从髂嵴或远端桡骨采集尺寸与空腔缺损相等的皮质角质移植物。该程序的绿色修改需要两个平行的移植物放置,其中松质骨表面彼此面对[116]。在最初的描述中,舟骨用平行的克氏针稳定,虽然也可以使用压缩螺钉并提供更稳定的结构(图7.9)。完成手术后,用不可吸收的缝合线封闭囊切开术。该程序的结果是多种多样的,并且似乎最依赖于骨折的位置。 Dacho治疗总共84名患者,报告总体结合率为82%,近端骨折的结合率为81%[117]。然而,Barton报告的愈合率仅为54%,大多数失败发生在近端骨折[118]。 Green的研究证实了这一点,该研究报告的愈合率为71%,受到近端骨折愈合不能愈合的较高发生率的负面影响[116]。
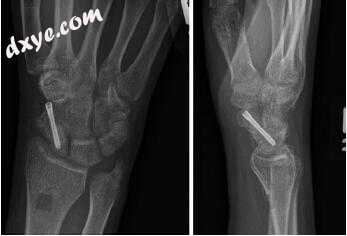
图7.9远端桡骨皮质移植治疗无舟状骨缺损的舟状骨骨不连,矫正驼背畸形并固定到位
涉及可行的近端极的骨折最好通过背侧方法进行管理。背侧方法允许改进进入近端杆以便移除不存活的硬化骨并允许顺行螺钉放置。近端骨折的方向通常是从远端掌侧到近端背侧,因此一个手掌放置的螺钉有可能使近端碎片移位而不会穿过骨不连部位的中心[36]。可以从腕关节中间的纵向切口或者从Lister's结节到第二掌骨底部的斜切口接近舟状骨[36,65]。然后可以将胶囊纵向分开或用胶囊分裂[119]切口分开。在背侧囊膜分裂切口中,背侧桡腕韧带(DRC)从Lister's 结节的远端分裂到三角肌,而背侧腕骨间韧带(DIC)从三角肌切开到舟状骨远端。 。由此产生的韧带瓣从尺骨升至背部以便以后修复。可以切开伸肌支持带的远端方面,并且Lister的结节可以用于松质骨或皮质松质骨移植物。与掌侧方法一样,识别不愈合部位并用刮匙或高速毛刺除去坏死骨。放置在舟骨的每个杆中并用作操纵杆的克氏针可有利于减少骨折。一旦骨折已经减少并且已经放置了骨移植物,则在荧光镜引导下放置用于空心螺钉系统的导丝。通过手腕的弯曲促进线的放置。可以放置第二根偏心线以防止钻孔和螺钉放置时的断裂旋转。完成病例后,用不可吸收的缝合线封闭囊切开术。在没有骨坏死的情况下检查背侧入路和骨移植的文献是有限的。 Inoue等人。 [120]报道了16名患者,其中13名继续进行放射学联合治疗。
无论是掌侧还是背侧接近骨折并伴有大量骨丢失,导致螺钉固定后的稳定性问题,可以插入第二根螺钉或克氏针作为增强[121,122]。使用第二个螺钉需要事先计划,因为第一个螺钉必须定位在舟状骨的任一侧,以便为第二个螺钉留出空间。克氏针通常留在原位,直到出现断裂固结的射线照相外观。加西亚等人。据报道,共有19名患者通过掌侧或背侧方法放置2个加压螺钉和骨移植物治疗。所有骨折均在3.6个月内进行愈合[122]。
对于具有固定驼背畸形的舟状骨或具有导致DISI畸形的掌侧舟状骨的大空洞病变的患者,需要掌侧方法来完全矫正和稳定畸形。费尔南德斯描述了一种最初由Fisk开发的治疗腕关节不稳定治疗这些舟状骨不连的方法的改进。他的技术的关键组成部分如下:(1)使用对侧腕关节的术前X线片评估正确的舟状骨长度和对准; (2)使用掌侧方法; (3)从髂嵴插入楔形皮质角膜移植物,以在切除假关节后纠正对齐; (4)用压紧螺钉[65,123]稳定。 Fisk的技术使用桡骨茎突骨移植,由于髂嵴的压缩强度较大,Fernandez对其进行了修改。 Fernandez报道了使用这种技术治疗的20名患者中的19名患者的放射治疗,平均工作时间为8.9周[123]。 Eggli等。发现了类似的结果,37名患者中的35名实现了结合。在2例未愈合的病例中均存在先前存在的骨坏死[124]。
7.5.3带有骨坏死的舟骨骨不连
一般认为,血管化骨移植物在近端骨坏死的情况下是必需的,或者当传统的骨移植未能实现愈合时(图7.10)。这一研究证实了在骨坏死[115,116,120,
124-126。在一项犬类研究中,Sunagawa等人。据报道,如果使用血管化移植物,联合率为73%,传统移植物为0%[127]。已经描述了多个移植物源,最常见的是从远端桡采集并在完整的蒂上旋转的移植物。其他技术包括来自第二掌骨和尺骨的蒂移植物,来自内侧股骨髁的自由移植物,髂嵴和肋骨肋软骨交界处以及动脉化。
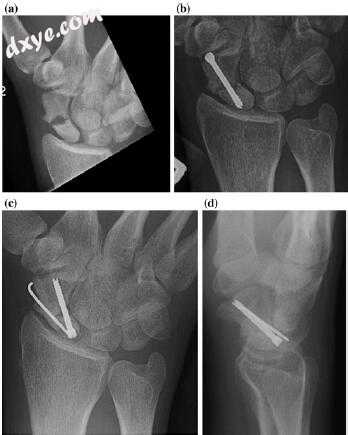
图7.10舟骨性腰椎骨折的慢性不愈合。 b压迫螺钉固定4个月后,掌侧非血管化骨移植并持续骨折不愈合。 c,d图像修复固定后不愈合与背侧1,2室间室上动脉血管化骨移植和螺钉和克氏针固定与骨折愈合
从远端桡收集移植物的技术基于Sheetz等人描述的远端桡骨的综合血液供应。 1995年[101]。它们与舟状骨的紧密接近比其他技术具有一些优势。他们的采集需要最少的额外暴露和解剖,并且它们在完整的蒂上旋转,消除了对微血管吻合的需要[85]。背侧移植物通常基于1,2或2,3个室内上行动脉,而掌侧移植物来自掌侧腕骨动脉[65,83,85]。背侧移植物所基于的桡骨远端的营养血管由它们与腕关节伸肌室和伸肌支持带的关系命名[65]。 1,2室间室上动脉(ICSRA)位于第一和第二背室之间的伸肌支持带浅表,而2,3 ICSRA也是表面的,位于第二和第三室之间[65]。 1,2 ICSRA从桡腕关节近端5厘米的桡动脉起始。 2,3 ICSRA有较长的蒂,可能允许更大的移植物旋转[85]。一种额外的移植物,常用于治疗月骨坏死(Kienböck病)。
Zaidemberg等人首次描述了1,2 ICSRA的采集。在1991年,它可能是最常用的移植源,部分原因在于它在伸肌支持带上的一致位置[36,65,128]。背侧桡骨皮肤切口在第一和第二背侧隔室之间的桡腕关节上居中,以允许暴露于舟骨和远端桡骨。止血带通常用于手术,但是不进行放血以便识别动脉。必须识别和保护浅表感觉桡神经的分支。进行细致的钝性解剖,直到识别出1,2 ICSRA,因为它从桡动脉背侧向后延伸,位于第一和第二隔室之间的伸肌支持带上。动脉通常表现为细红色条纹。第一和第二伸肌隔室肌腱被释放。第二隔室的肌腱缩回,并且第一隔室肌腱桡缩回。通过在动脉两侧的骨膜中以所需的移植物长度进行平行切口来操作动脉蒂。蒂不应移动到关节线附近超过10-15毫米,因为这是营养血管进入骨骼的区域。然后将蒂释放到接近桡动脉的水平以允许移植物旋转。
然后采集所需尺寸的移植物。
作者建议使用骨凿进行移植物采集,尽管一些外科医生会使用摆动锯。动脉近端结扎,止血带应放气以确认血液流过蒂。如前所述,制备不愈合部位,完全切除任何坏死骨。也可以在移植物采集之前进行骨不连的制备。克氏针线控操纵杆再次用于控制舟状骨移植物和骨折复位。压缩螺钉用于固定,因为它们具有比克氏针更好的结合率[129]。如果骨折碎片完全不稳定,可先放置固定,然后通过皮质窗口撞击移植物[65]。
1,2 ICSRA移植物的使用在文献中已经证明了混合的结果。 Zaidemberg等人。 [128]报道在他们的原始技术文章中使用该程序治疗的所有11名患者的联合。 Chang等人治疗的50个不愈合中有34个。手术后平均15.6周继续愈合。持续性骨不连的危险因素包括高龄,舟状骨近端骨坏死,术前驼背畸形,缺乏螺钉固定,吸烟和女性[129]。 Straw等人。 [130]报告较不成功的结果,22名患者中只有6名实现了结合。值得注意的是,他们使用克氏针固定,这可能会对联合率产生负面影响。
如前所述,基于掌侧腕骨动脉,还描述了来自掌侧远端桡骨的血管化骨移植物。 Gras和Mathoulin报道了38例接受手术治疗的患者的联合率为89.5%,所有患者均接受过手术治疗。射线照相联合的平均时间为10.8周[131]。该技术对于骨坏死和驼背畸形或舟状骨的大的掌侧骨缺损的组合可能特别有用,其需要掌侧楔形移植物用于畸形矫正。该问题的其他选择包括背侧入路采用放射状切除术以促进ICSRA的掌侧放置,背侧入路采用血管化的第二掌骨移植蒂进行手掌旋转,或两种单独的方法采用掌侧楔形移植物矫正畸形和ICSRA移植物提供血管分布[83]。
类似于远端桡骨的移植物,第二掌骨血管化移植物是带蒂的移植物,其可以旋转到舟状骨缺损中。移植物基于第二背掌骨动脉或背侧腕骨间弓,并且可以从掌骨的背部头部或基部采集。蒂不穿过腕关节,理论上降低了由于血管扭结引起的闭塞风险。它可以从单一背侧方法或双重方法中采集,其中它被旋转并置于掌侧舟状骨缺损中[85]。
Mathoulin和Brunelli [132]报道了15例接受掌骨头移植的患者的愈合率为93%,愈合时间为4个月。尽管联合率很高,但只有10名患者具有可接受的功能结果和2名持续的桡神经刺激。 Sawaizumi等。 [133]使用来自近端掌骨的移植物,认为它允许采集更大的骨头。他们报告说,接受该手术治疗的所有14名患者平均在10.2周内接受治疗。值得注意的是,他们的研究中未包括术前骨坏死的存在。
利用尺动脉作为蒂的尺骨骨移植物代表了治疗无血管舟状骨不连的另一种选择。与游离血管化移植物相比,该方法具有一些优点,包括可预测的血管蒂,大的骨膜层和降低的供体部位发病率[85,134]。最大的缺点是移植物利用尺动脉作为蒂,这需要用插入的静脉移植物分割和重建动脉。在Guimberteau和Panconi的一项研究中,所有8例接受手术治疗的患者均在平均4.6个月内接受放射治疗,并恢复到之前的工作或运动水平而没有术后并发症[134]。鉴于与尺动脉分裂和重建相关的可能的并发症以及患者平均2次手术失败,该手术可能在翻修手术中最有用,其中已经使用了桡骨远端蒂移植物。
关于游离的血管化移植物,已经描述了从股骨内侧髁,髂嵴和肋骨软骨表面采集的技术。自由血管移植物提供增强的结构支撑,例如矫正驼背畸形所需的支撑。潜在的并发症包括用于移植物采集的第二次手术切口的发病率和用于移植物吻合的微血管技术的失败[85]。股骨内侧髁移植物基于来自下行膝状血管或上内侧膝状血管的蒂[135]。琼斯等人。 [135]比较1,2 ICSRA和股骨内侧髁移植物治疗舟骨骨不连伴近端骨坏死。所有12例内侧股骨髁移植物治疗患者均愈合,而10例接受1,2 ICSRA移植治疗的患者中只有4例治愈。内侧股骨髁组的平均愈合时间为13周,而1,2 ICSRA的平均愈合时间为19周。髂嵴自由移植物可以利用髂深血管作为蒂采集结构良好的髂嵴嵴移植物[136]。 Arora等。 [136]治疗了21例有骨质疏松症并且之前手术干预失败的患者。他们报告的联合率为76%,平均结合时间为17周,没有供体部位并发症。 Al-Jabri等人。 [137]进行了系统评价研究,其中骨不连的患者用股骨内侧髁或髂嵴游离移植物治疗。他们报道,56例接受内侧股骨髁移植术治疗的患者合并率为100%,188例接受髂嵴移植术治疗的患者合并率为87.7%。
肋骨肋软骨游离血管化骨移植的支持者称其用于舟状骨近端的明显塌陷[138-140]。在第9肋骨上放置水平切口,并暴露肋软骨关节的骨软骨质表面。用振荡锯采集骨软骨栓,并将其轮廓与近端舟状骨的解剖结构相匹配。切除舟状骨的近端,并用螺钉或可移除的克氏针将植入物植入并固定到远端杆上。 Sandow回顾了47例接受手术治疗的患者[138]。所有患者均报告功能评分改善,无需在3个月的平均随访时进行额外的抢救手术。在另一项随访时间较长的研究中,Veitch等人。报告14例患者中有13例功能改善[139]。在两项研究中,与残余舟状骨的移植联合为100%。 Tropet等。 [140]报道了18例平均随访时间为4。1年的患者,其中15例发现优良或良好,2例均为良好,1例患者为差,其中移植物半脱位。
还描述了第二背侧掌骨动脉或背侧指动脉直接植入舟状骨,并且主要用于先前手术和有限血管化骨移植物选择的设置。称为动脉化,该程序首先由Hori等人描述。在犬模型[141]。 Fernandez和Eggli [142]报道了11名患者使用该手术,其中10名患者继续治愈骨折。尽管联合率很高,但50%需要随后的手术,包括放射形切除术和有限的腕关节固定术。另外两例接受过手术的患者的病例报告显示骨折愈合成功[143,144]。
作者的首选治疗算法:在患有AVN证据的已确诊舟状骨不连的患者中,作者首选的方法是使用1,2 ICSRA带蒂移植物进行血管化骨移植的加压螺钉固定。然而,对于曾经进行过手腕背部手术或创伤或患有明显驼背畸形的患者,作者认为从背侧不能矫正,可考虑掌侧入路和掌侧血管化,带蒂移植物[131]。在考虑自由血管重建之前,提供具有非常近端骨折的患者在这些技术中的一种中被提供固定。
7.5.3.1术后管理
在用于舟状骨不连的常规或血管化骨移植物之后,患者最初被置于短臂夹板中。这将在2周时转换为短臂,直至术后3个月或射线照相愈合。在3个月时,患者被转换为可移除的短臂夹板,仅在用于治疗的温和范围的运动练习中移除。持续夹板直到X线片显示骨折愈合。此外,任何与受影响肢体的提升都会延迟,直到X光片显示联合。术前应告知患者他们会出现明显的手腕僵硬,需要大量的治疗才能恢复力量和活动范围。他们还应该被警告说,术前X光片可以延迟愈合,平均时间在术后3到5个月之间结合[128-131]。虽然这不是作者实践的一部分,但可以考虑补充使用骨刺激器(低强度脉冲超声或电刺激),特别是在先前手术失败,治疗显著延迟或术前骨坏死的患者中。里卡多等人。据报道,用骨刺激器治疗的骨坏死患者加速愈合时间(38天)[145]。目前没有证据支持使用一种刺激剂而不是另一种,迄今为止尚未进行过比较试验。
7.5.4舟状骨不连续塌陷(SNAC)抢救程序
随着显著的桡腕关节或中腕退行性改变,舟状骨骨不连的手术治疗不太可能产生有意义的结果。如本章前面所述,舟状骨塌陷导致腕关节不稳定的DISI模式,退行性变化以类似舟月韧带不稳定性晚期塌陷(SLAC)的模式发展[78]。第一阶段SNAC退行性变化局限于桡骨茎突。第二阶段涉及整个桡舟关节。在阶段III中,退行性变化扩散到冠状动脉关节,并且在阶段IV中,观察到全身性关节炎。
I期腕部可采用舟骨固定和骨移植联合桡骨指甲切除术治疗。通过切除茎突,保护掌侧桡骨韧带附着很重要。切除大于1 cm的桡骨茎突可导致舟骨结节桡舟头韧带起源不稳定[65]。
在阶段II中,退行性变化的进展涉及整个桡舟关节,因此需要使用运动保留补救程序。远端舟状骨的切除是需要较低的舟骨腰部和远端骨折患者的一种选择。 Malerich等人。 [145]报道19例接受手术治疗的患者握力增加134%,运动范围为85%。术后4年平均无DISI畸形影像学表现。 Ruch等人。在远端切除术后平均4年内,13名患者表现出令人满意的结果[146]。然而,13例中有6例有DISI畸形的影像学恶化。对于更活跃的患者,近端行椎体切除术(PRC)和带有4角融合术的舟状骨切除术是手术选择。与融合相比,近端行椎体切除术具有技术要求较低的优点,没有骨不连的风险,术后固定时间较短,术后康复极少。 PRC与舟状骨切除和4角融合的比较表明患者满意度,握力和运动范围在PRC治疗[147]。对于他们的对侧肢体,患者可以期望恢复70-80%的握力和50-60%的运动范围[147]。射线照片通常会显示关节炎进展到冠状动脉关节,但这几乎没有功能影响,因为大多数患者仍无症状[148]。
随着关节炎在第三阶段进展为中腕关节,近端行椎体切除术不再是一种选择,并且指示舟状切除和4角融合(图7.11)。头状,月骨和三角之间的关系是融合的位置,其目的是维持一致的放射性关节。生物力学研究表明,在手术后,负荷优先转移到放射性关节,因此在术中确认关节没有明显的退行性变化是很重要的。该程序在技术上也比PRC要求更高,并且获得融合的整合可能具有挑战性。月骨的矫正不足会导致头状胬肉在背部半脱位位置融合,并且疼痛的放射性基台可防止手腕伸展[65]。植入设计是一个正在进行研究的领域。克氏针,圆形板,压紧螺钉和钉的技术都被用于开发刚性,薄型植入物的目标。理想的植入物还可提供足够的骨压缩并最大限度地减少软组织刺激。使用圆形板的结果好坏参半。 Skie等。 [149]报道37名患者中只有29名(78%)联合。尽管在11名接受圆形钢板治疗的患者中有10名患者达成了联合,但Chung等人。发现大多数患者继续出现持续性腕关节疼痛,1例患者需要切除疼痛的硬件[150]。最后,Shindle等人。报道16例接受圆形钢板治疗的患者中有9例出现并发症,包括骨不连(25%),延迟愈合(6%),背侧撞击(25%),桡骨茎突冲击(6%)和螺钉断裂(13%)[ 151]。
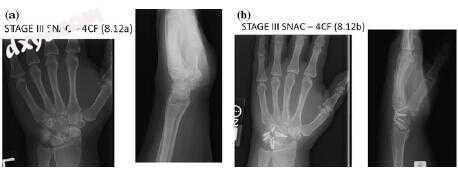
图7.11舟状骨不愈合晚期塌陷III期关节炎改变。 b用舟状骨切除术和四角融合术治疗
在第IV阶段,放射性关节的退行性累及或全潘氏关节炎的存在是腕关节融合的指征。应该注意的是,这是缓解抢救手术的疼痛,对手腕功能具有显著影响,并且决定继续进行应该基于外科医生和患者之间的协作讨论。
7.5.5舟头骨折综合征
头状花序位于腕骨中心,受到很好的保护,是一种罕见的腕骨骨折部位。事实上,头状骨折仅占所有腕骨骨折的1-2%。头状骨折可以单独发生,但更常见的是跨舟骨周缘骨折脱位的一部分。被Fenton称为舟头综合症,如果没有正确诊断并得到充分解决,它将导致头颅骨不连[65,152]。
由于腕部过度伸展和轴向负荷导致舟状骨骨折,头状突起能够过度伸展。头盖颈部对远端桡骨背脊的撞击产生头状颈部的横向取向骨折。当手腕恢复到中立位置时,腕骨的缩短防止了近端骨折碎片的减少。随着进一步的腕屈曲,头状碎片的远端杆在近端碎片上施加屈曲力,导致不稳定的近端碎片旋转180°。最终产品是旋转不良的骨折,其中近端的关节面在骨折部位面向远端[65,152]。临床诊断可能具有挑战性,因为初始PA,侧位和斜位X线片可能具有减少的头状外观。结果,这些损伤最初可能会被遗漏,并且仅在骨折再吸收发生后才被诊断出来。因此,一些外科医生建议使用低阈值来获得CT扫描,以便在更大的电弧损伤情况下更准确地评估头状不规则[153,154]。
头状骨的骨内血液供应类似于舟状骨,因为头部的背侧和掌侧血管通过逆行流向近端提供血管供应。此外,与舟状骨一样,头状骨的近端几乎完全是关节内的,并且头部几乎完全被关节软骨覆盖。来自头部的微弱血液供应导致头状骨易受骨坏死[155]。由于环月状骨脱位的韧带不稳定性和导致的骨折不稳定性,这进一步复杂化。
如果急性识别,这些损伤应采用开放复位和头状内固定治疗,同时明确管理包括舟状骨骨折和环月状骨脱位在内的伴随伤害。可以通过第三和第四伸肌隔室之间的标准背侧接近来接近头状物。应通过本章前面所述的背囊分离方法切开背侧囊,保留并随后修复DRC和DIC韧带至三角肌。在环月状骨脱位的环境中经常会出现背侧囊膜撕裂,应尽可能将其纳入囊袋入路。手腕的弯曲便于进入头状头部。通过2个无头螺钉减少骨折并通常稳定。关于舟头综合症的文献完全由小病例系列和病例报告组成,其中最大的一例包括三名患者[153,154,156-160]。这些报告的共识是,在没有骨坏死的情况下,急性和延迟性开放性复位以及这些损伤的内固定导致良好的短期功能结果。
治疗头状骨不连,特别是骨坏死,不太直接。在延迟表现,诊断或建立不愈合的情况下,MRI可用于评估近端骨坏死。头状骨不愈的治疗目标不仅是骨折愈合,还要重新确定头状高度[161]。如果不这样做,将导致肩胛骨棘突和三角关节骨关节超负荷,导致早期退行性变化。可能需要皮质松质骨移植来矫正头状缩短。当显著的腕骨退行性变化发展时,可能需要有限的腕骨融合。在近端塌陷之前,已经描述了用血管化骨移植物尝试恢复血流,但是没有公布长期结果[155]。在近端塌陷后,问题最好由腕骨融合[65,155]来控制。
7.5.6 钩骨勾
钩骨勾骨折是罕见的损伤,仅占所有腕骨骨折的2%[65]。与钩骨体裂缝相比,钩骨钩的骨折发生得更频繁。在运操作中,钩状骨折的钩子比一般人群更常见,特别是那些参与球拍运动的人,如高尔夫,网球和棒球。损伤后的表现可能会延迟,如果没有急性固定,会导致骨不连的风险增加。
钩骨勾的解剖结构既使其受伤,也会导致骨折移位和骨不连的可能性。钩子从钩骨基部凸出地突出到小鱼际隆起中,其中来自球杆或球棒的手柄的直接压缩可导致骨折。钩是屈肌腱的起源,最小的指小肌,小鱼际肌和豆钩韧带以及腕横韧带的远端插入点。来自这些肌肉中的每一个的剪切力以及尺骨指的相邻屈肌腱都可能导致骨折移位。 Failla描述了钩骨的血管供应,并提出为什么与身体相比,尖端骨折的骨坏死风险增加[162,163]。钩骨体的骨间肌血液供应通过三个血管蒂的组合进入桡基部,而钩由来自尺骨动脉并进入尖端的营养血管供应。在Failla的研究中,钩骨勾的营养血管仅存在于71%的样本中。此外,在基部和钩的营养动脉之间存在最小的侧支流。流向尖端的血流量有限可能导致骨坏死的风险。
最初的临床表现通常包括在小鱼际隆起的基础上的慢性疼痛。钩骨勾形成Guyon管的侧缘,用于将尺神经和动脉运送到手掌中。患者还经常抱怨环和小指中的尺神经感觉异常,以及抓握力的丧失和抓握活动引起的疼痛恶化。有些人会描述特定的伤害,最初的急性疼痛会变成钝痛。许多人将描述由于症状而无法恢复体育活动或表现下降。触诊的柔软性通常存在于钩骨勾上,钩骨勾是豌豆的远端和桡。考虑到环和小屈肌腱与钩子的紧密接近,钩骨勾拉试验会使疼痛加剧[164]。施加环和小指肌腱的抗弯曲。手腕尺骨偏离时手指屈曲抵抗,疼痛加剧,桡偏差改善。很少发生慢性骨折,只有在深部或浅表肌腱破裂后才能确定。
在标准PA,侧位和斜手或腕部X线片上通常很难识别损伤。 PA射线照片可能为伤害提供一些线索。这些包括钩区域中钩骨的硬化和钩骨远端桡角处没有皮质环标志,其代表钩形放射线。根据临床病史怀疑受伤,腕管视图,旋后斜视图和侧视图投射在第一端上,拇指被外展,这些都被认为是更好地可视化钩骨的工具[65]。旋后斜肌在临床研究中具有最高的敏感性[165]。当诊断仍不清楚时,指示CT扫描[165,166]。 CT是诊断骨折的最有效方法,灵敏度为100%,特异性和准确性均大于90%。 CT也可用于排除双重钩骨,这是一种存在于少数患者体内的解剖变异体。
当急性诊断时,钩的非移位骨折通常通过铸造和固定来治疗。研究表明,延迟的损伤表现导致保守治疗效果不佳[167]。在确定的骨不连的情况下,单独使用石膏固定治疗的愈合率低得令人无法接受。病例报告报道了使用石膏固定和使用低强度脉冲超声成功治愈骨不连[168]。如前所述,未治疗骨不连的患者存在屈肌腱断裂的风险。这导致了对症状性骨不连的外科治疗的趋势。从历史上看,建议切除非骨折碎片。这在运操作中尤其具有吸引力,因为与其他治疗方法相比,它可以提供更快速的回归。有人担心切除可能会对屈肌腱功能产生负面影响,因为钩子起到屈指肌腱与小指的支点的作用。生物力学研究表明,钩子切除导致屈肌腱力减小,随着手腕进入伸展位置和尺骨偏离,效果恶化[169]。因此,一些作者提出尝试使用钩板或压紧螺钉进行开放式复位和内固定。在有或没有骨移植的情况下尝试固定仅在文献中的小系列或单个病例报告中进行了研究。尽管有足够的愈合率,但已经证实固定超过片段切除没有临床益处[169]。
钩骨勾的手术方法类似于用于减轻Guyon管的方法。曲线切口指向片段。应注意不要越过近端手掌屈曲褶皱,以避免瘢痕挛缩。手掌的前臂筋膜被分开,并且尺骨神经和动脉在近端被识别并且被跟随到Guyon管中。横向腕骨韧带连接到钩的尖端并且包括Guyon管底,从钩骨勾的插入点释放。然后应该从钩的基部周围小心地操作尺动脉和神经。深部运动分支到尺神经背侧尺神经节的神经分支,深入到屈指数最小。运动分支通常直接位于位于钩子底部的裂缝附近。一旦动脉和神经被操作并且在没有张力的情况下安全地缩回,则骨折从钩骨的身体进行骨膜下切除。剩余的骨膜可以在骨折部位闭合,或者骨折表面可以是柔软的,以防止尺神经和屈肌腱的进一步刺激。
如前所述,片段切除后恢复游戏和活动比手术固定或封闭管理更快。手术切口的愈合和通过冲击活动解决疼痛通常决定了恢复运动的时间。在迄今为止对棒球运操作进行的最大规模的研究中,切除术后的平均回归时间为5.7周[170]。瘢痕敏感性是常见的并发症,术后物理治疗侧重于瘢痕手法和脱敏。运操作经常会穿着特别带衬垫的手套,并且最初会重新开始比赛。
7.6掌骨和指骨不愈合
骨折和趾骨骨折后骨不连是一种罕见的并发症[171]。当涉及其他复杂因素如显著的软组织损伤,神经血管损伤,感染或骨质流失时,不愈合的风险增加。固定不充分,适当减少和维持减少失败,以及通过破裂碎片过度运动可以防止骨折联合[172]。
认识到骨不连的存在是治疗并发症的第一步。根据定义,骨不连或延迟愈合是在损伤后4个月或损伤后6个月骨性愈合失败后无临床或影像学表现的骨折[171,172]。这一原则的关键在于理解联合的放射学证据往往落后于临床发现,不应作为骨折愈合的唯一指标。一旦确定了不愈合或延迟联合,就应该探索因果关系。必须密切评估感染的体征和症状。伴有掌骨或指骨的节段性缺损的骨质流失,具有失活骨的血管性伤口床,或软组织覆盖不足的显著挤压伤,是阻碍愈合的损伤机制的所有特征。然而,通常是固定失败导致骨不连。单独使用克氏针在不稳定的断裂模式或硬件故障中可导致不稳定性,从而阻止穿过骨折线的愈合。
与其他骨不连和延迟愈合一样,将病情分类为肥厚或萎缩有助于直接治疗。掌骨和趾骨的肥厚性骨不连是相对罕见的,而且大多数是萎缩性的[173]。肥厚性骨不连是骨折碎片固定不充分导致骨折碎片过度相对运动的结果,所有这些都在充足的血液供应和健康的愈伤组织形成环境中进行。这导致稳健的成骨细胞反应而没有桥接骨折线。然而,更常见的是,掌骨和趾骨的不愈合在本质上是萎缩的[173]。当手中看到萎缩性骨不连时,需要进行仔细的检查以确定病因。在这种情况下,骨折生物学受到诸如感染,神经血管损害,软组织剥离或丢失,代谢混乱的一般医学状况等因素的影响。
7.6.1治疗
在某些显著的软组织或神经损伤的情况下,表明不愈合的非手术治疗。当严重污染的挤压伤或其他严重骨折和软组织损害的机制出现时,通常会导致血管指。很少指出试图固定和覆盖骨折,如果保留,手指通常会成为手的整体功能的障碍。在这些情况下应考虑关节固定术或截肢术,特别是当受伤区域沿着射线远端或涉及较小的指时。
掌骨和趾骨的肥厚性骨不连的治疗方法与涉及体内其他骨骼的方法相同。这种骨不连的病因是骨折的稳定性不足,这会抑制桥接愈伤组织的形成。存在骨折区域中愈伤组织的射线照相证据,但断裂线仍然清晰可见。然而,骨折环境的生物学对于骨形成是足够的,并且仅需要更有利的构造用于愈合。在这种情况下,治疗包括通过骨折碎片增加稳定性和压缩,以允许骨愈合。这通常通过压缩螺钉固定来实现,如果断裂形态是合适的,接着是刚性中和固定层,或单独的刚性固定层。
萎缩性骨不连需要仔细评估促成因素,如代谢混乱,营养不良,感染,严重不稳定,或在伤后初期/手术期间未遵守规定的活动限制。此外,骨折部位的节段性骨缺损或失活骨是骨折愈合的重要抑制剂。在解决了这些因素之后,通过骨移植增强的板 - 螺钉构造的稳定固定以填充任何骨缺损将最大化功能性愈合的可能性[174]。应该清除骨折边缘,并且在施用新构建体之前应该去除纤维桥接组织或插入的无血管骨的任何迹象。然而,重要的是,在此过程后,必须就所有患者残余僵硬的可能性提供咨询。外科医生应该大力考虑软组织的释放,包括刚性固定时的十囊固糖溶解,以最大化成功结果的几率,并促进引导治疗方案的早期运动[175,176]。夹板以避免挛缩和适当的水肿控制和镇痛以允许早期治疗阶段对于获得良好的功能结果是至关重要的。
作者优选的骨移植算法:使用或采集的骨移植物类型以及同种异体移植物与自体移植物的类型由骨不连的类型以及骨不连的位置决定(表7.1)。例如,肥大性骨不连可以在没有移植物或有限同种异体移植物的情况下进行治疗,例如脱矿质骨基质。然而,作者认为与节段性缺损或空隙或萎缩性骨不连相关的骨不连最好用自体移植物治疗。
参考:Nonunions Diagnosis, Evaluation and Management |


