马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
由于腹腔镜的广泛使用和逐渐扩大的适应症,胆囊切除术目前是最常见的腹部手术,在选择性或紧急的基础上进行。与传统的开腹手术相比,腹腔镜胆囊切除术最大限度地缩短了住院时间和围手术期死亡率。尽管通常被认为是安全的,但胆囊切除术可能会导致不良后果,且发病率不可忽略。此外,令人担忧的出血和胆道并发症的发生率并未受到技术转变的影响。由于越来越多的医疗法律问题和大量的胆囊切除术,放射科医生越来越多地被要求调查最近接受手术的患者。为了提高对胆囊切除术后横断面成像的熟悉程度,本文简要介绍了适应症和手术技术,并说明了预期的术后早期影像学表现。之后,开放,转换,腹腔镜和腹腔镜内镜下交会胆囊切除术后的大多数医源性并发症进行了回顾,包括感染,血肿和活动性出血,残余胆总管结石,胰腺炎,胆道梗阻和渗漏。多排螺旋计算机断层扫描(CT)代表了快速调查术后腹部的“主力”模式,以便为保守治疗,介入治疗或手术治疗之间的适当选择提供可靠的依据。重点放在早期磁共振胰胆管造影(MRCP)和额外的钆托酸增强MRCP的作用,以提供对手术胆道的非侵入性解剖和功能评估。
教学点
•尽管最小化了围手术期死亡率和住院时间,腹腔镜检查现已成为进行胆囊切除术的第一线方法,即使是急性胆囊炎患者也是如此。
•腹腔镜,腹腔内镜交会,转换和开放式胆囊切除术仍与不可忽视的发病率相关,包括手术部位感染,出血,残余结石,胰腺炎,胆道梗阻和渗漏。
•对比增强型多排螺旋CT(CT)在胆囊切除术后越来越多地被要求,并代表了“主力”模式,可快速提供对胆道和腹部手术的全面评估。
•磁共振胰胆管造影(MRCP)是提供手术胆道解剖学可视化的最佳方式,并在怀疑胆道并发症时显示。
•额外的钆布酸(Gd-EOB-DTPA)增强的MRCP非侵入性地提供功能性胆汁评估,以确认和可视化胆汁泄漏。
关键词:胆囊切除术,腹腔镜检查,并发症,计算机断层扫描(CT),磁共振成像(MRI)
介绍
背景
引入腹腔镜后,胆囊切除术的数量在20世纪90年代稳步增加。最近,手术的适应症扩大,腹腔镜胆囊切除术现已成为急性胆囊炎的首选方法,除非是败血症或一般情况不佳。因此,胆囊切除术目前是最常见的腹部手术,并且每年在美国进行超过750,000次手术[1]。
虽然通常被认为是一种安全的手术,但胆囊切除术可能会导致不良后果,并且发病率不可忽略,偶尔也会有死亡率。与传统的开腹胆囊切除术相比,腹腔镜检查使围手术期死亡率和住院时间最小化,并允许早期恢复正常活动,并具有美容上可接受的结果。意大利大型系列包括超过13,600名患者(其中86.1%的患者通过腹腔镜手术)分别报告了2.1%和2%的医疗和手术30天并发症;腹腔镜检查的优势在于年龄组,胆结石疾病的严重程度和之前的手术,并且对于老年人的急诊入院和全身并发症无关紧要[2]。在其他研究中,与开腹胆囊切除术后7.7%的总并发症发生率相比,腹腔镜胆囊切除术相关的发病率介于1.9%至6.5%之间。发生术后不良事件的风险与外科医生和医院数量无关,并且与紧急情况和患者因素有关,例如高龄,男性,合并症(包括肥胖和肝硬化),胆道炎症和纤维化胆囊。此外,在急性胆囊炎患者中,与开腹胆囊切除术相比,腹腔镜胆囊切除术可降低术后发病率,死亡率和住院时间,尤其是肺炎和伤口感染率[2-7]。
不幸的是,胆囊切除术后出血和胆道损伤的发生率并未受到技术转变的影响。两项研究报告说,医源性并发症是声称的常见原因,尤其与延迟诊断和(误)管理胆管和血管损伤有关。因此,由于越来越多的医疗法律问题和大量手术,放射科医生越来越多地要求在最近的胆囊切除术后对患者进行调查[8,9]。
目标
本文概述了当代开腹和腹腔镜手术技术,并总结了近期胆囊切除术后术后横断面成像的适应证。之后,它展示了预期的术后计算机断层扫描(CT)和磁共振成像(MRI)外观和评论,以及开放和腹腔镜胆囊切除术后最常见和不常见的早期(手术后一个月内发展)医源性并发症的例子。目的是为放射科医师提供对早期术后横断面成像的熟悉程度。重点放在CT作为“主力”模式,关于MRI与磁共振胰胆管造影(MRCP)和额外的钆松酸增强MRCP的作用,以提供对手术胆道的无创,综合解剖和功能评估[10] -14。
胆囊切除术:技术和适应症
20世纪80年代末在欧洲开发,作为传统开放手术的替代方案,微创腹腔镜胆囊切除术获得了广泛认可,并已成为症状性胆石症的金标准治疗方法。标准技术使用四个端口,通过闭合(Veress针)或打开(使用钝器或Hasson的套管针)进入创建肺气管膜。在通过夹住胆囊管和胆囊动脉所代表的关键步骤之后,解剖并提取胆囊[15,16]。在操作期间,胆汁溢出发生在高达10-40%的手术中,最常见于急性胆囊炎和具有挑战性的解剖学,但在大多数患者中不会引起问题。然而,腹腔镜检查的使用越来越多,导致溢出胆结石的发生率更高(4-6%),如果未经检查,可能会被置入腹腔并形成感染病灶[17-19]。
多年来,腹腔镜技术经历了修改。具体而言,一些外科医生试图减少端口的大小和数量,以改善美容和术后结果,直到单点腹腔镜胆囊切除术所代表的最新发展。通常不再放置腹腔内引流管,因为它们的使用不受证据支持[15,16]。
腹腔镜胆囊切除术的适应症已扩大到包括胆石性胰腺炎和急性和慢性胆囊炎。根据2018年“东京指南”,根据Charlson合并症指数和美国麻醉医师协会(ASA)分类[20,21],“尽快”进行的腹腔镜胆囊切除术代表了急性胆囊炎的首选治疗方案,如果与患者的状态相符则。
在腹腔镜胆囊切除术之前,应根据共存的胆总管结石的风险对患者进行分层。虽然低风险患者可以直接接受手术,但高风险患者需要术前内镜逆行胰胆管造影术(ERCP)和括约肌切开术来清除CBD。相反,中度风险患者应接受MRCP选择合适的管理策略[20]。
在包括院在内的一些机构,急性胆囊炎和胆总管结石患者采用一期腹腔内镜下术中交会技术治疗,导致术后住院时间短,并降低ERCP术后胰腺炎的风险[22]。
如今仍在世界许多地区进行,当腹腔镜胆囊切除术不可行或失败时,仍然需要进行开腹胆囊切除术。为了降低医源性损伤的风险,1.9-7.5%的患者需要进行腹腔镜胆囊切除术至开腹胆囊切除术的术中转换,原因是(a)严重发炎,坏疽或穿孔的急性胆囊炎或(b)由于解剖学不充分而难以进行手术标志,粘连或术中出血。在相同的情况下,开腹或腹腔镜胆囊切除术是一种有效的替代选择[23,24]。
早期胆囊切除术后成像
横断面成像的适应症
及时的术后成像和对预期发现和可能的并发症的认识应该允许正确检测和分级并发症,从而允许适当的管理[10-14]。
实际上,外科医生怀疑任何在胆囊切除术后没有迅速恢复或在出院后返回急诊室的患者会发生医源性损伤。表1.1列出了腹腔并发症的常见物理和实验室表现。尽管超声检查可以快速检测手术床中的异常集合,腹膜积液和胆管扩张,但在大多数手术后情况下,多排CT可以快速且一致地提供手术腹部的全景可视化,并且通常为医源性并发症的诊断增加了重要信息[ 10-14]。
Precontrast扫描可用于检测CBD的溢出胆结石和残余结石,Hounsfield单位(HU)的测量以及液体和血液收集的衰减。在肺部或骨窗设置观察可以简化金属外科钉和自由或局部腹腔内空气的识别。在2.5-4 mL / s流速下自动注入110-130 mL 300-370 mgI / mL碘化造影剂(根据瘦体重和碘浓度)后,可以使用推注跟踪获取动脉期扫描在肾下主动脉中具有感兴趣区域,10秒延迟和120HU阈值的技术。旨在检测活动性出血,如果不存在临床和实验室出血迹象并且预先对比扫描未显示血肿,则可以避免动脉期(CT血管造影)限制放射剂量。重建厚板最大强度投影(MIP)图像有助于可视化手术引流的过程,改善活动性出血的检测,并在考虑栓塞时为介入放射科医师提供血管路线图。强制性门静脉期采集通常在造影剂注射开始后75-80秒获得。
CT解释和通常的术后早期发现
表2.2中提供了用于解释胆囊切除术后CT研究的实用检查表。 根据作者的经验,由于请求紧急CT的门槛较低,大多数胆囊切除术后研究显示出预期或接近正常的外观。

图1
a-c在无并发症的开腹胆囊切除术后48小时预期的CT表现,包括最小的残留腹腔内空气(* a),引流管(粗箭头)到位和手术夹附近的胆囊窝内的最小液体(箭头)。 d-f腹腔镜胆囊切除术后不久出现CT预期,手术床内液体最少(箭头); 通过使用骨窗设置改善胆囊管和动脉处金属夹的可视化(f)

图2
a,b在无并发症的腹腔镜胆囊切除术后,套管针进入部位的常见CT表现。 轴向(a)和冠状(b)图像显示穿过轻度增厚的左腹直肌的管状非增强低密度结构(箭头)。 这个正常的发现应该与c区分开来,c是腹腔镜下套管针进入后右侧外斜肌和内斜肌内发生的顶内脓肿(c中的箭头),表现为局部肿胀
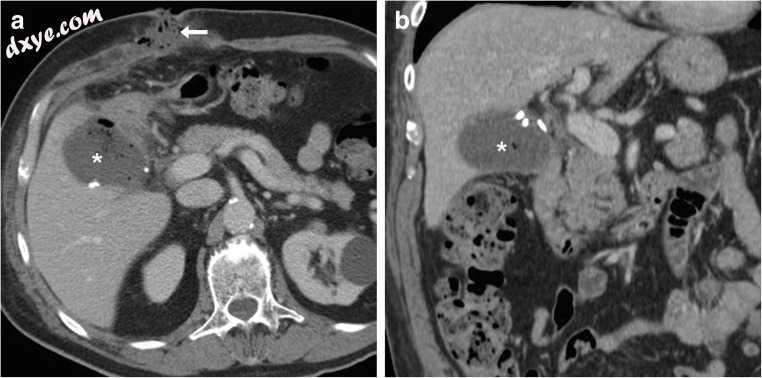
图3
胆囊脓胸开放胆囊切除术后3天,未见感染的术后收集(*和a中为*)伴有轻度不均匀的液体含量和气泡,占据了与手术夹相邻的胆囊窝,并且在没有定向手术的情况下退化。此外,临床诊断的伤口感染表现为不均匀的液体材料,在剖腹手术切口部位有稀疏的气泡(箭头a)
在最近的胆囊切除术后,手术床中通常存在有限量的液体(图1)。具有混合空气和液体含量的未感染的集合通常在术后第一周内见于胆囊窝(图(图33和图4)4),随着时间的推移可能形成可感知的壁,有时含有血液(图(图5).5)。术后收集的可能模拟表现为胆囊切除术后胆囊残余扩张(图(图6)6)和止血剂如Surgicel™(氧化再生纤维素),表现为40-50 HU的复杂集合。衰减和混合气体焦点[10-14]。

图4
胆囊窝中未感染的术后收集的常见外观。 在腹腔内镜下交会胆囊切除术后48小时,手术床被一个含有非依赖性空气和稠密液体的混合收集物(箭头)所占据,缺乏可感知的壁。 b,c腹腔镜胆囊切除术后开放性胆囊切除术后6天,存在大量不均匀的液体集合(箭头)和少量气泡。 两个集合在没有任何定向处理的情况

图5
在简单的腹腔镜胆囊切除术后手术床中的短暂血性收集。 a,b术后第8天,未增强的CT表现为卵圆形,划界的集合(箭头),具有高度衰减,与解决血液一致。 c,d在另一名患者中,术后第4天,T2-(c)和T1-(d)加权MR图像显示中等大小的不均匀集合(箭头),信号强度特征与亚急性血液一致。 两项研究结果均不需要输血或任何其他治疗

图6
模拟术后收集,在手术后2个月,在手术的胆囊窝中,在超声波(a)以及预先对比(b)和增强的(c)CT中观察到具有薄壁的含有流体的结构(箭头),这对应于 急性胆囊炎和胆囊十二指肠瘘开腹胆囊切除术后的胆囊残余
此外,在大多数情况下,胃肠道扩张反映了胃轻瘫和肠梗阻,而不是消化器官的医源性损伤(图77)。

图7
a-c腹腔镜胆囊切除术后早期CT术后显示胃扩张伴有积液,胆囊窝内液体最少(箭头a)和均匀的水衰减收集(*中b)从手术部位的夹子向较小的部位延伸囊,与胆汁瘤一致。插图c显示持续的胃肠气胀与术后肠梗阻一致,经皮腔引流(粗箭头)后胆汁瘤。 d,e腹腔镜胆囊切除术后不久,CT显示贴在十二指肠球部的夹子(d中的箭头),导致在透视检查期间口腔碘化造影剂转运受损(e)
术后早期MRI
与术前设置相似,MRI和MRCP序列是观察胆道手术的最佳方式,除了幽闭恐怖症,心脏起搏器或其他MRI不安全设备禁忌外,对评估疑似医源性胆道损伤具有至关重要的作用。在没有电离辐射的情况下,MRCP非侵入性地描绘了严重狭窄或阻塞的上方和下方的胆道,这是ERCP和经皮肝穿刺胆管造影所不可行的。如今,术后即刻的安全问题很小,因为大多数手术夹都是由非铁磁性材料制成的。此外,当前的呼吸触发采集限制了患者合作以获得有效诊断图像的需要。作者建议短暂(约15分钟)但全面的非对比MRI采集方案,包括冠状和轴向T2加权,然后是轴向脂肪饱和的T2加权,输入和输出T1加权(或者,Dixon技术)和上腹部的高b值弥散加权图像,其次是厚板和体积薄层MRCP序列[27]。
MRI和MRCP的解释应集中于胆囊窝收集,肝周围液,弥漫性或节段性胆管扩张和导管不连续性的检测。在术后第一周内,胆囊窝内的微量液体或血液(图(图5)5)和邻近肝实质的短暂水肿(图(图8)8)不应报告为异常。在腹腔镜胆囊切除术后,可以识别出非扩张的胆囊管残余物(通常长1-2厘米,长达5-6厘米)(图9).9)。 MRCP准确评估胆管狭窄或切除损伤的程度,程度和长度,这是适当治疗选择和规划的关键信息。 MRCP可能存在的缺陷包括:(a)倾向于高估口径变化,(b)肺胆,(c)金属夹的磁化感假象,(d)肝总管的流动伪影和(e)液体集合的叠加(图(图9)9)[27-29]。
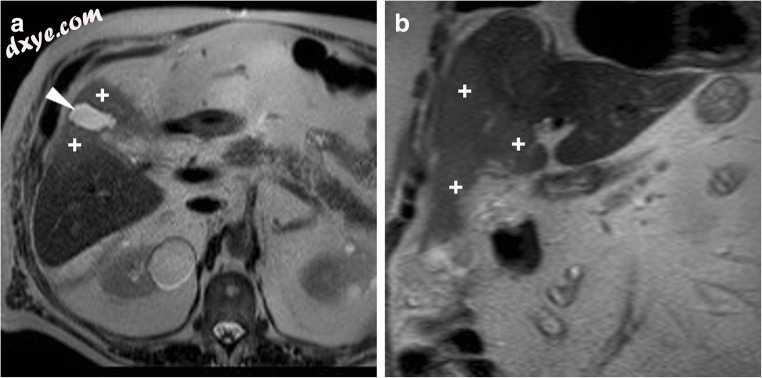
图8
无并发腹腔镜胆囊切除术后24小时预期MR出现:轴位(a)和冠状位(b)T2加权图像显示胆囊窝内小液体采集,肝实质信号强度增加(+),反映术后短暂肝水肿

图9
在腹腔镜胆囊切除术后2周观察到典型的胆汁瘤(*),其中CT衰减收集在CT(a)处与胆囊窝相邻。几天后,MRI显示胆汁瘤的形状和大小不变,均匀的液体和T2加权(b),表观弥散系数图(c)和MRCP(d)的无限制扩散。可以看到一条小的液体眶(细箭头)将胆小管连接到肝实质。冠状(e)钆特酸增强的MRCP图像显示胆总管(箭头)和短胆囊管残余(箭头)的胆汁浑浊,并且没有填充胆汁瘤,这归因于小周围胆汁的密封泄漏胚根
钆酸增强MRCP
最后,额外的钆特酸增强MRCP(图(图9e)9e)可能有助于确认和可视化疑似胆漏,尤其是黄疸,血清胆红素异常或恶化和肝功能检查的患者,以及术后成像显示了暗示胆汁瘤的持续性液体收集(如后面所述)。由功能性肝细胞摄取,开发了肝脏特异性MR造影剂以改善肝脏病变的检测和表征。其中,钆酸(钆乙氧基苄基二亚乙基三胺五乙酸或Gd-EOB-DTPA; Primovist,Bayer Schering Pharma,Berlin,Germany)结合了细胞外顺磁性和肝脏特异性对比的特征。通过胆系统以50%的比例排出,导致胆汁T1缩短,因此可以与各向同性体积插值的T1加权梯度回波序列(如体积加速肝脏采集[LAVA])一起使用, T1加权高分辨率各向同性体积检查[THRIVE]或体积内插屏气检查[VIBE]),以在注射后45-60分钟(任选90分钟)获得超延迟胆道相位图像。如果保留肝功能,钆喷酸增强的MRCP可视化不透明的肝内和肝外胆管和胆囊管残余(图9e),并且可以允许检测渗出的胆汁进入收集物,肝周围液或两者,从而提供诊断确认和胆漏的解剖学定义[30-32]。
胆囊切除术后感染和出血并发症的成像
浅表和手术部位感染
通常在临床上诊断,伤口感染在开腹胆囊切除术后仍然相对常见(1.8-2.73%)(图(图3a),3a),而不是腹腔镜检查(图(图2c).2c)。结合开腹或腹腔镜胆囊切除术的深部感染罕见(总发生率低于1%),但胆囊结石术后溢出的风险更高(约3%)[17-19]。
大多数位于胆囊窝(图(图10)10)和Morison's囊中,手术部位感染出现在CT上,具有特征性的脓肿外观,包括液体样脓性内容和外周增强边缘。在其中,高钙含量的胆结石下降表现为单个或多个过度衰弱的病灶,使用宽窗口设置最佳识别。相反,胆固醇过少或未钙化的胆结石很容易被发现。在MRI中,溢出的胆结石显示出低信号强度并且是瘢痕可以察觉或解释为碎片。另外,肝周围感染是由于术后无菌或胆管的重复感染引起的(图11)[27,33]。借鉴急性胰腺炎的最初经验,扩散加权核磁共振成像可能能够在术后无菌和感染之间实现自信区分,后者在高b值扩散图像中显示外周明亮信号,并显示相应的低表观扩散系数值[34]。

图10
由于胆囊穿孔和感染胆汁的腹膜内溢出,腹腔镜胆囊切除术后开腹胆囊切除术后观察到胆囊窝脓肿(*),超声检查(a)视为具有不均匀的低消声结构的卵形切除良好的肝下收集。 未增强(b)和后对比(c)CT图像证实占据手术床的脓肿收集,主要是流体含量,非依赖性空气和薄增强周边壁。 微弱的钙化碎片(c中的箭头)对应于掉落的胆结石。 需要经皮CT引导引流来缓解产超广谱β-内酰胺酶(ESBL +)大肠杆菌感染。 (部分转载自Open Access参考文献[43])

图11
两例非典型位置的术后感染。右侧膈下脓肿(*)在紧急腹腔镜胆囊切除术后2周与肝脏裸露区域相邻,后者通过开放式外科引流治疗(克雷伯氏菌培养阳性)。 b,c沿着右肝叶的后侧面进行外周增强收集,与脓胸(*)一致,经肝引流治疗(未显示)
脓肿通常需要手术或经皮引流,并且可以使用肾镜或篮子去除掉落的胆结石,以防止复发风险[17-19]。保留的手术海绵在CT上显示为混合衰减肿块,容易与脓肿集合或血肿混淆。虽然不常见,更具体的迹象包括薄的过度衰弱的外周“囊”,内部不透射线的标记和反映被困气泡的“海绵状”图案[35]。
出血
手术中和手术后出血仍然是开放性和腹腔镜胆囊切除术的一种并不常见且可能严重的并发症,报告的总体发病率可变(从低于1%至4.5%)。据报道,伤口血肿使剖腹手术切口近3%复杂化。腹腔内出血由手术床引起,继发于血管结扎或止血不充分,囊性或右肝动脉的热或机械损伤,并且在开腹手术期间比腹腔镜控制更具挑战性。另外,腹腔镜套管针入口可能伤害腹壁的小血管(例如腹壁下动脉)或肠系膜血管[2-7]。
在无并发症的胆囊切除术后,可在手术床中观察到一些血液(图(图6)6)。 横断面成像一致地描述了临床上显著的血肿及其特征性的CT高度衰减和亚急性血液的MRI信号强度(图12,12,1313和14).14)。 造影剂外渗的检测(图(图14)14)表明活动性出血并且需要进行紧急外科修复或经动脉栓塞(图14)[10-14]。
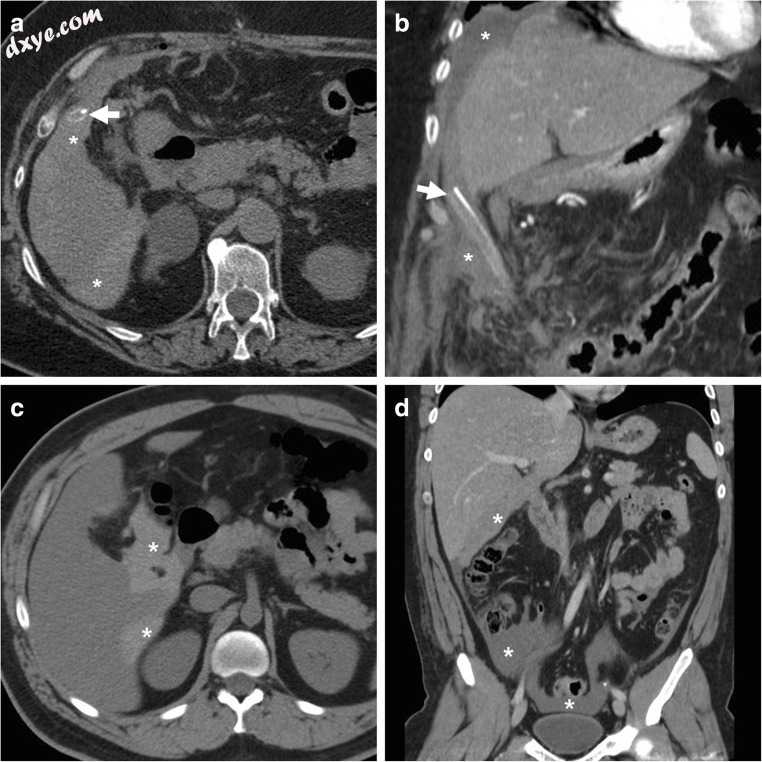
图12
胆囊切除术后出血最常见的外观。 a,b腹腔镜胆囊切除术后开放性胆囊切除术后48小时,CT显示肝周血(*)在对比扫描中与肝脏等衰减(a),从引流外渗出(粗箭头),两条动脉均无明显对比外渗( b)和静脉(未示出)增强阶段。 需要再次介入才能在胆囊窝和网膜上实现止血。 c,d腹腔镜胆囊切除术后第3天,对比增强(c)和对比增强(d)CT图像显示右侧肝叶下右侧肝外科手术床延伸的高反应性新鲜血液(*),右侧腹膜切除术和腹膜切除术岛区囊。 通过定位经皮引流治疗患者

图13
胆囊切除术后出血的非典型部位。 腹腔镜胆囊切除术后24小时在超声(a),前对比(b)和增强(c)CT上观察到的巨大的包膜下血肿(*),通过经皮引流和输血治疗引起肝脏压迫。 注意腹腔镜胆囊切除术后第3天在未增强(d)CT上观察到残留的腹腔内空气(+)d,e十二指肠和前肾上腺血肿(*),引流(粗箭头)仍然存在,没有对比剂腮红,表明活跃动脉期CT出血(e); 在保守治疗(包括输血)的随访CT(未显示)中,血肿的大小和衰减趋于消退

图14
腹腔镜胆囊切除术后48小时诊断为活动性出血,在动脉(a)和门静脉(b)CT图像中,肝内血肿(*)内血管外造影“红晕”(箭头),经血管造影证实(c)并通过栓塞有效治疗
胆囊切除术后胆道并发症的影像学表现
残留性结石,急性胆管炎和胰腺炎
在最近的手术后,MRCP提供了对手术胆道的全面可视化,因此可以准确检测梗阻部位和特征,以及胆管扩张原因之间的区别,如保留的胆结石(图15)。 ),无意中CBD剪切,热损伤和异常收集的外在压缩[27,28]。
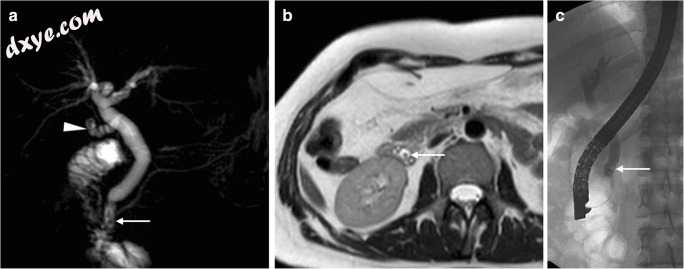
图15
最近(10天)腹腔镜胆囊切除术后,在另一家医院进行的胆总管残留结石(CBD)。 MRCP(a)和轴向T2加权(b)MR图像显示不明显的胆囊管残余(箭头)和轻微扩张的CBD,具有小的依赖性填充缺陷(细箭头)。在ERCP(c中的细箭头)确认残余结石,并使用Dormia篮子通过括约肌切开术和拔除进行治疗
与开放手术相比,除非采用交会技术,否则腹腔镜胆囊切除术无法探查CBD。不常见的是,在操作期间或手术后不久,保留的结石可能从胆囊管迁移到CBD。在腹腔镜胆囊切除术之前未获得MRCP时风险最高。即使在非扩张的CBD中,MRCP也能可靠地检测到内部充盈缺损(图(图15).15)。与MRCP相比,CT对胆结石的敏感性要低得多,需要重点审查(图16).16)。 ERCP伴括约肌切开术是主要的治疗方法[27,28]。

图16
腹腔镜胆囊切除术后残余结石和胆管炎,尽管术前ERCP仍在发展。在术后第6天,CT(a-c)显示残留的腹腔内空气(+ a),通常收集于胆囊窝(*中b),“斑驳”肝实质增强和肝内胆管双侧扩张。聚焦的冠状图像(c)显示远端CBD的一块小石头(细箭头),由ERCP确认和治疗
胆汁的重复感染可能导致急性胆管炎,这在MRI中表现为沿着肝内门静脉分支和主要门静脉的液体样炎症“追踪”和T2加权图像上的节段性肝水肿。通过使用钆贝酸或非特异性钆螯合物在动态对比增强MRI上显著增强胆管壁和相应的楔形或胆管周围实质动脉增强来加强诊断。此外,胆道或门静脉脓毒症偶尔可能导致肝脓肿的形成[36,37]。
与ERCP术后设置类似,急性胰腺炎(图(图17)17)是腹腔镜内镜下交会胆囊切除术的典型后遗症[38]。

图17
术后急性胰腺炎(血清脂肪酶15,000 U / L)经腹腔内镜下术后交会胆囊切除术。手术后24小时,对比增强CT和引流就位(粗箭头)显示胰腺保持增强和胰周积液的发展(*)。对患者进行鼻胆管引流定位治疗,最终形成假性囊肿
胆道梗阻
大约1%的腹腔镜胆囊切除术后出现了可怕的胆道梗阻,这个数字几乎是开腹胆囊切除术的两倍,通常是继外科医生对正常或变异胆道解剖结构的误解。经典的腹腔镜胆囊切除术后损伤是由肝外眦BD的横切或结扎而不是胆囊管造成的。或者,早期胆道梗阻可能是由于未被识别的异常胆管切除或胆道热损伤引起的[12,28,29,39]。
在MRCP中,胆道梗阻通过在狭窄的管道上方的弥漫性或节段性管道扩张或全层不连续性预示(图18).18)。使用聚焦重建,CT(图(图18)18)可以更好地描绘高度减弱的错位金属夹和上游胆管扩张。传统的外科手术Bismuth系统允许将医源性损伤分类为I型(位于胆管汇合处远端2 cm以上),II型(距胆道分叉处小于2 cm),III型(肝总管缺失,完整汇合)和IV型(完全或部分受损的胆道汇合)[27-29,39]。
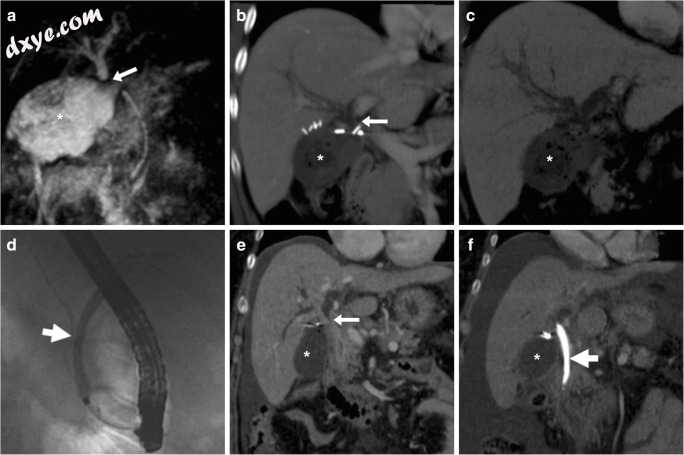
图18
2例患者胆道梗阻来自医源性早期腹腔镜胆囊切除术后胆道损伤。 a-d术后第5天,MRCP(a)显示胆囊窝(*),扩张的肝内导管和近端CBD突然终止(箭头)和正常胆总管远端的术后收集。附加的聚焦对比增强CT图像(b)更好地显示金属夹和MIP图像(c)描绘了扩张的肝内胆管。扩张的肝总管长14毫米,与铋II型损伤一致。在ERCP(d)确认不能通过的阻塞后,需要重新手术以移除错位的夹子。 (改编自参考文献[44]的许可。)e,f术后第12天,CT(e)显示腹水,手术床中的液体收集(*)和可能导致热损伤的CBD狭窄(箭头),通过支架的定位进行内窥镜治疗(术后CT中的粗箭头,f)
在过去,医源性阻塞经常进行手术修复并需要进行胆肠吻合术。相反,如今,ERCP和胆道支架术(图(图18)18)代表了首选的管理[40]。
胆漏
与胆道梗阻相似,腹腔镜胆囊切除术后发生胆漏最常见(发生率为0.4-1%)比开腹胆囊切除术(0.1-0.5%),并且在28-40%的病例中被归类为主要。超过一半(60%)的病例是由于胆囊管的结扎不足或脱落造成的。按频率降序排列,其他原因包括:(a)深层解剖后胆囊床上的渗漏,以去除紧密粘附的胆囊;(b)对附件胆管无意撕裂,横断或热损伤,(c)部分撕裂主要的管道或CBD [41,42]。
在横断面成像中,识别具有与胆汁积聚一致的特征的集合引起对潜在渗漏的关注。 无论是在手术窝还是在肝下位置,大多数情况下,胆汁积聚都显示出均匀的水CT衰减值和所有序列上简单流体的MRI信号特征(图7b,7b,b,99和19)。)。 直到最近,胆瘘的临床诊断依赖于来自外科引流管的胆汁输出,并确认胆漏需要侵入性(内窥镜或经皮)胆管造影。 如今,使用钆酸增强的MRCP可以有效地诊断胆汁瘤并从其他非胆道术后收集中分化,这也可以精确显示渗漏部位,甚至可以从排除的分支中进行(图1919和图20) )20)[30-32]。

图19
在腹腔镜胆囊切除术后第7天,急性MR包括脂肪饱和的T2加权(a)和MRCP(b)显示大胆的胆汁(*)从胆囊窝腹侧延伸,一些腹膜液和轻度扩张的CBD包含多个毫米的填充物 与石头一致的缺陷(b中的细箭头)。 钆塞酸增强的MRCP证实残留的胆总管结石(c中的细箭头)并且允许从胆囊管残余物(箭头)检测到小的胆漏(箭头d),导致胆汁瘤的混浊(*)。 内镜治疗包括括约肌切开术和自扩张金属支架的放置
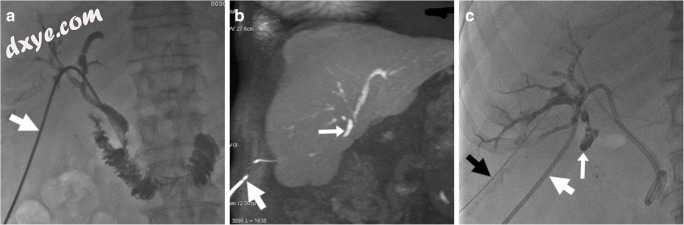
图20
在最近的选择性腹腔镜胆囊切除术后,胆囊窝(未示出)的低输出胆汁损失仍然存在,尽管经皮治疗时栓塞定位并且在胆管造影术中没有胆漏(a)来自经皮经肝胆管引流术(PTBD)(粗箭头)。 钆酸增强的MRCP(b,冠状MIP重建图像)显示在第6段分支的起点处增强的胆汁的活性渗漏,被塞子排除。注意沿着PTBD(粗箭头)的高信号,产生胆汁。针对第6节段分支的重复经皮胆道造影(c,黑色粗箭头)确认渗漏(箭头)。胶水栓塞(Glubran 2,GEM,Viareggio,意大利)加Lipiodol最终可以解决瘘管问题
虽然存在不同的分类系统,但从实际角度来看,成像应有助于区分可能保守治疗的轻微泄漏(例如来自外周胆汁的泄漏),以及需要干预的主要导管泄漏和CBD损伤。大的胆汁瘤可以进行经皮成像引导引流。内镜管理(括约肌切开术,鼻胆管引流术和支架置入术)是主要和胆囊管泄漏的主要和高效方法(图19)。或者,已经研究了与CBD断开的泄漏管道的纤维蛋白胶堵塞(图(图20)20)。手术(胆肠吻合术)保留用于ERCP失败[40-42]。
结论
横断面成像在腹腔镜,转换和开放式胆囊切除术后早期术后并发症的诊断中起关键作用。根据作者的经验,多检测器计算机断层扫描(CT)可快速提供对手术室的全面评估。此外,磁共振胰胆管造影术(MRCP)和钆特酸增强MRCP被推荐用于阐明疑似胆囊切除术后胆道并发症,以便为保守,内窥镜或手术治疗之间的选择提供一致的依据。
缩略语
CBD 胆总管
CT 计算机断层扫描
ERCP 内镜逆行胰胆管造影
Gd-EOB-DTPA 钆塞酸 (gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid)
HU Hounsfield units
LAVA 肝脏加速容积采集
MIP 最大强度投影
MRCP 磁共振胰胆管造影
MRI 磁共振成像
PTBD 经皮经肝胆管引流术
THRIVE T1加权高分辨率各向同性体积检查
VIBE 容积内插式屏气检查
参考:
Early cross-sectional imaging following open and laparoscopic cholecystectomy: a primer for radiologists
1. Stinton LM, Shaffer EA. Epidemiology of gallbladder disease: cholelithiasis and cancer. Gut Liver. 2012;6:172–187. doi: 10.5009/gnl.2012.6.2.172. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
2. Agabiti N, Stafoggia M, Davoli M, Fusco D, Barone AP, Perucci CA (2013) Thirty-day complications after laparoscopic or open cholecystectomy: a population-based cohort study in Italy. BMJ Open 3. pii: e001943 [PMC free article] [PubMed]
3. Murphy MM, Ng SC, Simons JP, et al. Predictors of major complications after laparoscopic cholecystectomy: surgeon, hospital, or patient? J Am Coll Surg. 2010;211:73–80. doi: 10.1016/j.jamcollsurg.2010.02.050. [PubMed] [CrossRef] [Google Scholar]
4. Murphy MM, Shah SA, Simons JP, et al. Predicting major complications after laparoscopic cholecystectomy: a simple risk score. J Gastrointest Surg. 2009;13:1929–1936. doi: 10.1007/s11605-009-0979-3. [PubMed] [CrossRef] [Google Scholar]
5. Coccolini F, Catena F, Pisano M, et al. Open versus laparoscopic cholecystectomy in acute cholecystitis. Systematic review and meta-analysis. Int J Surg. 2015;18:196–204. doi: 10.1016/j.ijsu.2015.04.083. [PubMed] [CrossRef] [Google Scholar]
6. Halilovic H, Hasukic S, Matovic E, Imamovic G (2011) Rate of complications and conversions after laparoscopic and open cholecystectomy. Med Arh 65:336–338 [PubMed]
7. Yi F, Jin WS, Xiang DB, Sun GY, Huaguo D (2012) Complications of laparoscopic cholecystectomy and its prevention: a review and experience of 400 cases. Hepatogastroenterology 59:47–50 [PubMed]
8. Alkhaffaf B, Decadt B. 15 years of litigation following laparoscopic cholecystectomy in England. Ann Surg. 2010;251:682–685. doi: 10.1097/SLA.0b013e3181cc99fd. [PubMed] [CrossRef] [Google Scholar]
9. Scurr JR, Brigstocke JR, Shields DA, Scurr JH (2010) Medicolegal claims following laparoscopic cholecystectomy in the UK and Ireland. Ann R Coll Surg Engl 92:286–291 [PMC free article] [PubMed]
10. Thurley PD, Dhingsa R. Laparoscopic cholecystectomy: postoperative imaging. AJR Am J Roentgenol. 2008;191:794–801. doi: 10.2214/AJR.07.3485. [PubMed] [CrossRef] [Google Scholar]
11. Lohan D, Walsh S, McLoughlin R, Murphy J (2005) Imaging of the complications of laparoscopic cholecystectomy. Eur Radiol 15:904–912 [PubMed]
12. Kim JY, Kim KW, Ahn CS, et al. Spectrum of biliary and nonbiliary complications after laparoscopic cholecystectomy: radiologic findings. AJR Am J Roentgenol. 2008;191:783–789. doi: 10.2214/AJR.07.3602. [PubMed] [CrossRef] [Google Scholar]
13. Choi JY, Kim MJ, Park MS, et al. Imaging findings of biliary and nonbiliary complications following laparoscopic surgery. Eur Radiol. 2006;16:1906–1914. doi: 10.1007/s00330-005-0135-8. [PubMed] [CrossRef] [Google Scholar]
14. Melamud K, LeBedis CA, Anderson SW, Soto JA (2014) Biliary imaging: multimodality approach to imaging of biliary injuries and their complications. Radiographics 34:613–623 [PubMed]
15. Haribhakti SP, Mistry JH. Techniques of laparoscopic cholecystectomy: nomenclature and selection. J Minim Access Surg. 2015;11:113–118. doi: 10.4103/0972-9941.140220. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
16. Gurusamy KS, Koti R, Davidson BR (2013) Routine abdominal drainage versus no abdominal drainage for uncomplicated laparoscopic cholecystectomy. Cochrane Database Syst Rev (9):CD006004 [PubMed]
17. Sathesh-Kumar T, Saklani AP, Vinayagam R, Blackett RL (2004) Spilled gall stones during laparoscopic cholecystectomy: a review of the literature. Postgrad Med J 80:77–79 [PMC free article] [PubMed]
18. Schäfer M, Suter C, Klaiber C, Wehrli H, Frei E, Krähenbühl L (1998) Spilled gallstones after laparoscopic cholecystectomy. A relevant problem? A retrospective analysis of 10,174 laparoscopic cholecystectomies. Surg Endosc 12:305–309 [PubMed]
19. Demirbas BT, Gulluoglu BM, Aktan AO. Retained abdominal gallstones after laparoscopic cholecystectomy: a systematic review. Surg Laparosc Endosc Percutan Tech. 2015;25:97–99. doi: 10.1097/SLE.0000000000000105. [PubMed] [CrossRef] [Google Scholar]
20. Ansaloni L, Pisano M, Coccolini F et al (2016) 2016 WSES guidelines on acute calculous cholecystitis. World J Emerg Surg 11:25 [PMC free article] [PubMed]
21. Okamoto K, Suzuki K, Takada T, et al. Tokyo Guidelines 2018: flowchart for the management of acute cholecystitis. J Hepatobiliary Pancreat Sci. 2018;25:55–72. doi: 10.1002/jhbp.516. [PubMed] [CrossRef] [Google Scholar]
22. Borzellino G, Rodella L, Saladino E, et al. Treatment for retained [corrected] 胆总管 stones during laparoscopic cholecystectomy: the rendezvous technique. Arch Surg. 2010;145:1145–1149. doi: 10.1001/archsurg.2010.261. [PubMed] [CrossRef] [Google Scholar]
23. Jara G, Rosciano J, Barrios W, et al. Laparoscopic subtotal cholecystectomy: a surgical alternative to reduce complications in complex cases. Cir Esp. 2017;95:465–470. doi: 10.1016/j.ciresp.2017.07.013. [PubMed] [CrossRef] [Google Scholar]
24. Nuzzo G, Giuliante F, Giovannini I, et al. Advantages of multidisciplinary management of bile duct injuries occurring during cholecystectomy. Am J Surg. 2008;195:763–769. doi: 10.1016/j.amjsurg.2007.05.046. [PubMed] [CrossRef] [Google Scholar]
25. Hindman NM, Kang S, Parikh MS. Common postoperative findings unique to laparoscopic surgery. Radiographics. 2014;34:119–138. doi: 10.1148/rg.341125181. [PubMed] [CrossRef] [Google Scholar]
26. Han NY, Sung DJ, Park BJ, Kim MJ, Cho SB, Kim YH (2014) Imaging of complications associated with port access of abdominal laparoscopic surgery. Abdom Imaging 39:398–410 [PubMed]
27. Hoeffel C, Azizi L, Lewin M, et al. Normal and pathologic features of the postoperative biliary tract at 3D MR cholangiopancreatography and MR imaging. Radiographics. 2006;26:1603–1620. doi: 10.1148/rg.266055730. [PubMed] [CrossRef] [Google Scholar]
28. Ragozzino A, De Ritis R, Mosca A, Iaccarino V, Imbriaco M (2004) Value of MR cholangiography in patients with iatrogenic bile duct injury after cholecystectomy. AJR Am J Roentgenol 183:1567–1572 [PubMed]
29. Ward J, Sheridan MB, Guthrie JA, et al. Bile duct strictures after hepatobiliary surgery: assessment with MR cholangiography. Radiology. 2004;231:101–108. doi: 10.1148/radiol.2311030017. [PubMed] [CrossRef] [Google Scholar]
30. Lee NK, Kim S, Lee JW, et al. Biliary MR imaging with Gd-EOB-DTPA and its clinical applications. Radiographics. 2009;29:1707–1724. doi: 10.1148/rg.296095501. [PubMed] [CrossRef] [Google Scholar]
31. Seale MK, Catalano OA, Saini S, Hahn PF, Sahani DV (2009) Hepatobiliary-specific MR contrast agents: role in imaging the liver and biliary tree. Radiographics 29:1725–1748 [PubMed]
32. Alegre Castellanos A, Molina Granados JF, Escribano Fernandez J, Gallardo Muñoz I, Triviño Tarradas Fde A (2012) Early phase detection of bile leak after hepatobiliary surgery: value of Gd-EOB-DTPA-enhanced MR cholangiography. Abdom Imaging 37:795–802 [PubMed]
33. Nayak L, Menias CO, Gayer G. Dropped gallstones: spectrum of imaging findings, complications and diagnostic pitfalls. Br J Radiol. 2013;86:20120588. doi: 10.1259/bjr.20120588. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
34. Islim F, Salik AE, Bayramoglu S, Guven K, Alis H, Turhan AN (2014) Non-invasive detection of infection in acute pancreatic and acute necrotic collections with diffusion-weighted 磁共振成像: preliminary findings. Abdom Imaging 39:472–481 [PubMed]
35. Kalovidouris A, Kehagias D, Moulopoulos L, Gouliamos A, Pentea S, Vlahos L (1999) Abdominal retained surgical sponges: CT appearance. Eur Radiol 9:1407–1410 [PubMed]
36. Watanabe Y, Nagayama M, Okumura A, et al. MR imaging of acute biliary disorders. Radiographics. 2007;27:477–495. doi: 10.1148/rg.272055148. [PubMed] [CrossRef] [Google Scholar]
37. Catalano OA, Sahani DV, Forcione DG, et al. Biliary infections: spectrum of imaging findings and management. Radiographics. 2009;29:2059–2080. doi: 10.1148/rg.297095051. [PubMed] [CrossRef] [Google Scholar]
38. Tonolini M, Pagani A, Bianco R. Cross-sectional imaging of common and unusual complications after 内镜逆行胰胆管造影. Insights Imaging. 2015;6:323–338. doi: 10.1007/s13244-015-0393-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
39. Khalid TR, Casillas VJ, Montalvo BM, Centeno R, Levi JU (2001) Using MR cholangiopancreatography to evaluate iatrogenic bile duct injury. AJR Am J Roentgenol 177:1347–1352 [PubMed]
40. Krokidis M, Orgera G, Rossi M, Matteoli M, Hatzidakis A (2013) Interventional radiology in the management of benign biliary stenoses, biliary leaks and fistulas: a pictorial review. Insights Imaging 4:77–84 [PMC free article] [PubMed]
41. Hii MW, Gyorki DE, Sakata K, Cade RJ, Banting SW (2011) Endoscopic management of post-cholecystectomy biliary fistula. HPB (Oxford) 13:699–705 [PMC free article] [PubMed]
42. Sultan AM, Elnakeeb AM, Elshobary MM, et al. Management of post-cholecystectomy biliary fistula according to type of cholecystectomy. Endosc Int Open. 2015;3:E91–E98. [PMC free article] [PubMed] [Google Scholar]
43. Tonolini M (2018) Subhepatic 脓肿 containing spilled gallstone following recent laparoscopic cholecystectomy {online}. EuroRAD URL: http://www.eurorad.org/case.php?id=15733
44. Tonolini M (2011) Iatrogenic bile duct injury following cholecystectomy: multimodal imaging diagnosis and classification {online}. EuroRAD URL: http://www.eurorad.org/case.php?id=9483 |


