马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
超微外科手术是一种0.3至0.8毫米的小血管解剖和吻合技术,它彻底改变了淋巴水肿治疗和软组织重建领域。该技术为显微外科医生提供了几个明显的好处,包括操纵以前无法进入的小血管的能力,并通过在超筋膜平面上解剖短蒂来最小化供体部位的发病率。因此,超微外科手术近年来越来越受欢迎,其应用自20年前首次推出以来已大大扩展。虽然超微外科手术最初是针对涉及挽救指尖端的手术而开发的,但该技术现在常用于各种显微手术病例,包括淋巴静脉吻合术,血管化淋巴结转移和穿支 - 穿支吻合术。通过不断的实验,超微外科训练的标准化以及专注于这些新方法成果的高质量研究,超微外科手术可以成为每个显微外科实践的常规和有价值的组成部分。
关键词:超微外科,显微外科,整形外科,游离皮瓣,穿支,软组织重建,淋巴水肿,淋巴结转移
介绍
最近的技术进步和外科技术的改进在重建显微外科领域开辟了一个新的时代。显微外科手术已从简单的软组织重建演变为这些技术的更复杂的应用,包括血管化淋巴结转移(VLNT)和穿支 - 穿支吻合术(1,2)。显微外科手术的结果和并发症发生率在过去几十年中有所改善,使今天的显微外科医生更多地关注最小化供体部位发病率并最大化重建的功能和美学(3)。最重要的是,今天的重建外科医生能够执行以前无法实现的手术,例如口径小于一毫米的血管吻合术。这些先进的程序归入超微外科领域(4,5)。
超微外科手术定义为血管和0.3至0.8 mm单神经束的微血管血管吻合技术(4)。手术技术采用高度精细的显微外科手术器械(30至80微米针状微缝线)来完成小吻合术(6)。 20年前首次引入该技术,该技术由Koshima等人开创。在涉及远端手指的血管修复的重建中。从那时起,该技术已被用于以前受小口径血管限制的重建。例如,超微外科手术允许在糖尿病足部伤口使用穿支 - 穿支游离式皮瓣,其具有受损的脉管系统和淋巴静脉吻合术(LVA)用于阻塞性淋巴水肿(7,8)。超微外科技术扩展了以前在显微外科领域可实现的可能性。
本综述总结了超微外科手术的发展历史,该技术的当前应用,超微外科手术的训练方法和未来发展方向。作者在PubMed数据库中搜索了以英语发布的文章。使用的关键词包括“超微外科手术”,“穿孔皮瓣”,“穿支到射支”,“重建显微外科手术”,“淋巴水肿”,“微血管吻合术”和“显微外科手术模拟”。与超微外科手术相关的原始和评论文章被审查。共审查并纳入了106篇文章,证据水平从I到V(表1)(9)。
表格1
治疗研究的证据水平。
超微外科史
显微外科领域可以追溯到20世纪60年代,当时通过一系列具有里程碑意义的实验程序将新的手术技术和术中放大倍数引入血管外科手术(10)。据报道,第一次微血管手术发生在1960年,当时JH Jacobson和EL Suarez在显微镜下成功地将一条犬颈动脉的两端连接起来(11)。随后,世界各地的许多先驱者开始开发可以演变为微血管手术的技术和工具。最终,该技术将首次用于成功地重新植入患者的截肢手和手(12)。正是在此期间,Harry J. Buncke在动物模型中进行了他现在著名的涉及组织移植的实验,并开发了许多显微外科的中心原则,这使他被指定为“显微手术的创始之父”(10)。
Buncke和20世纪60年代的其他显微外科先驱,包括John Cobbett,James Smith和Susumu Tamai,于1967年在纽约市举行的美国整形和重建外科学会年会上首次举办了显微外科小组讨论会(10)。这次会议标志着第一次现场交换显微外科技术,包括周围神经修复,数字转移和组织移植。在此次会议取得成功后,国际显微外科学会成立于1970年,并于同年举办了第一届微血管移植国际研讨会(10)。因此,在十年的过程中,显微外科领域诞生了。
1987年,泰勒和帕尔默提供了一个全身穿支图,使外科医生能够使用穿支血管进行安全的皮瓣修复,从而出现了微血管重建的新时代(13)。 Koshima等。然后发表了1989年第一次使用穿支皮瓣,深部下腹壁皮瓣,这预示着多年后(14)发生了各种不同的穿支皮瓣。利用分布在整个身体的“perforasomes”皮瓣的可能性创造了游离皮瓣重建的新范例,使外科医生在选择使用皮瓣时有更大的自由度(15)。
基于穿孔皮瓣的概念,Koshima报告在1997年第一次穿孔皮瓣和动脉化皮瓣国际疗程中首次使用基于口径小于0.8 mm的穿支血管的皮瓣。利用这种小血管进行吻合术的可能性这是非常重要的,因为这大大扩展了外科医生在选择游离组织瓣时的自由度,同时通过在解剖过程中保留筋膜,肌肉,神经和主要血管来降低供体部位的发病率。 Koshima等。他们在1998年对脐旁穿支皮瓣的描述中首次称这种技术为“超级外科手术”(16)。 2007年,Koshima在第一次关于显微外科创新技术的国际会议上将该技术称为“超微外科手术”,并于2010年公布了该手术的定义(5)。 2010年3月在巴塞罗那举行的第一届欧洲超级外科学会议上,对“超级外科手术”的名称达成了共识(4)。这项技术很快被世界各地的外科医生采用,并且一些研究开始报道使用小口径(<0.8 mm)(17-21)的血管成功使用穿支皮瓣和其他微血管手术。因此,超微外科手术的使用被发展为微血管重建进化的下一步。
在接下来的十年中,超微外科技术越来越多地被纳入显微外科手术工具包中。超微外科手术彻底改变了淋巴水肿的治疗方法,该技术还有助于挽救指尖再植和游离皮瓣重建(22-24)。此外,超微外科手术和随后的游离式皮瓣定制的出现使得重建不仅可以解决软组织覆盖问题,还可以解决功能恢复,慢性感染伤口控制和美容改善问题(19)。超微外科手术的实用性允许另一个操作自由度来进行重建。以下部分概述了其使用中的一些当前应用和争议。
目前的应用
淋巴水肿治疗
超微外科手术彻底改变了淋巴水肿领域,淋巴水肿是淋巴系统的一种慢性病,导致在间质空间中收集富含蛋白质的液体,严重影响患者的生活质量(25-30)。直到最近,淋巴水肿主要通过非手术物理疗法进行管理,包括压迫包裹,手动引流和运动,尽管脂肪抽吸和减瘤手术也被使用,取得了不同程度的成功(29)。超微外科手术的出现引入了LVA和超微外科手术VLNT的手术,这些手术正成为这种疾病的治疗选择(1,8,31)。
LVA涉及在皮下淋巴管和小静脉之间建立显微外科连接,以绕过远端末端的淋巴引流。吻合术可以通过端对端,端对端或侧对端技术(32)进行(图1)。使用远端末端的淋巴管,因为远端淋巴管受淋巴水肿的影响较小,因此更容易用于旁路。此外,皮下淋巴管和小静脉是LVA的首选血管,因为皮下静脉的静脉压较低,导致静脉回流较少(3)。成功的LVA需要超微外科技术,因为淋巴管具有小的血管口径,通常小于0.5毫米。因此,尽管LVA最初是在20世纪60年代报道的,但自从超微外科手术出现以来,它一直是成功地进行的(25)。
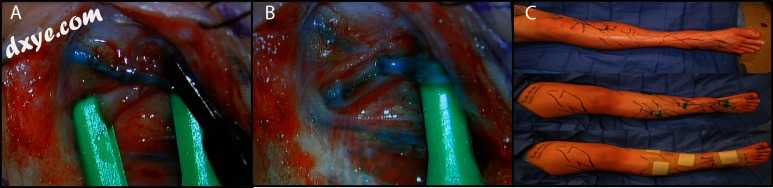
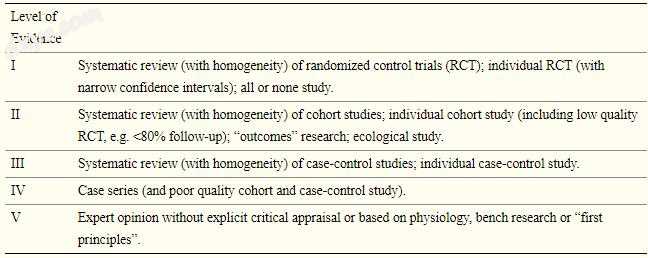
图1
通过端对端技术进行淋巴吻合术。淋巴管和静脉显示为夹紧的(A)。吻合术后,流出静脉和淋巴管松开以显示血流(B)。对每个肢体依次进行许多淋巴静脉吻合以改善淋巴流出(C)。
Koshima等。首先报道了他们在1996年使用超微外科手术进行LVA的经验(33)。从那时起,该技术已被用于全球各种机构的淋巴水肿治疗,并作为淋巴水肿手术治疗的主要选择获得了显著的牵引力(34)。最近成像技术的创新使外科医生能够更好地评估淋巴管的通畅性和功能,允许更可靠的计划并改善吻合术的长期通畅性(25)。例如,Campisi等人的一项研究。调查了1,800例LVA治疗的外周淋巴水肿患者,87%的患者主观改善,客观体积变化为83%。重要的是,在他们研究中随访的患者中,85%的患者能够停止使用保守措施,平均随访时间为10年,过量患者平均减少69%(35)。其他研究同样报道了LVA后淋巴水肿的阳性定量和定性改善(31,32,36-39)。引入其他技术和改进程序可能会继续改善未来的结果(39)。
尽管如此,LVA用于淋巴水肿治疗仍然存在争议。尽管一些研究结果令人鼓舞,但其他研究报告的结果不太有利,包括体积减少或非手术治疗的益处(40)。 LVA是一项具有挑战性的技术,需要高水平的技术技能才能完成,其效益并不总是可见,并且仍然缺乏评估结果的客观方法(34)。这些缺点,加上少量的高质量研究和缺乏淋巴水肿治疗的临床算法,已经引起了对LVA技术的功效和作用的怀疑。目前,人们认为LVA的最佳适应症是对非手术治疗有抵抗力的早期淋巴水肿(25,41)。
除LVA外,VLNT还成功用于治疗淋巴水肿。 在VLNT中,含有血管化淋巴结的游离组织瓣从身体周围的各个供体部位之一转移到软组织缺损或水肿肢体上的非解剖区域,以重建淋巴流(1,40,42))。 常用的供体部位和相关淋巴结包括锁骨上(图2),腹股沟(图3),颏下,腋窝和胸部皮瓣(42)。 超微外科手术的使用允许用口径小于0.8mm的小穿支血管转移淋巴脂脂瓣,以及操作植入组织内或附近的小静脉和淋巴管(4,43)。 超微外科手术越来越多地用于VLNT,因为该技术允许使用更薄的皮瓣来减少供体部位的发病率并且可以改善淋巴引流(44)。
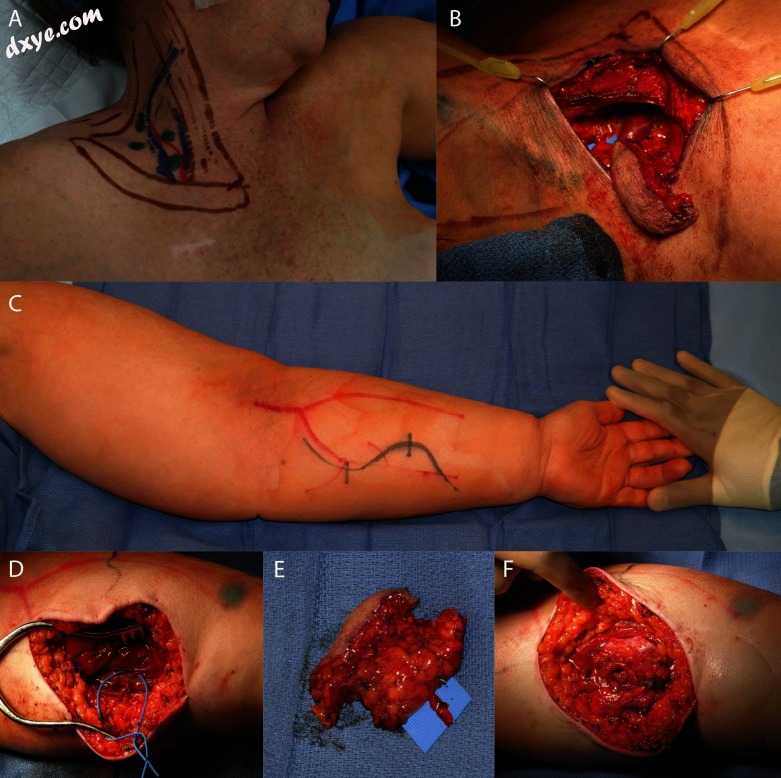
图2
锁骨上皮瓣。 血管化淋巴结的锁骨上供血部位的皮肤标记转移至上肢(A)。 用淋巴闪烁显像和ICG确认结节。 (B)显示采集后的皮瓣就位。 (C)显示接受者水肿的上肢。 (D)显示切除的受体动脉和静脉。 (E)显示切开的皮瓣,(F)显示插入和去上皮后的皮瓣。
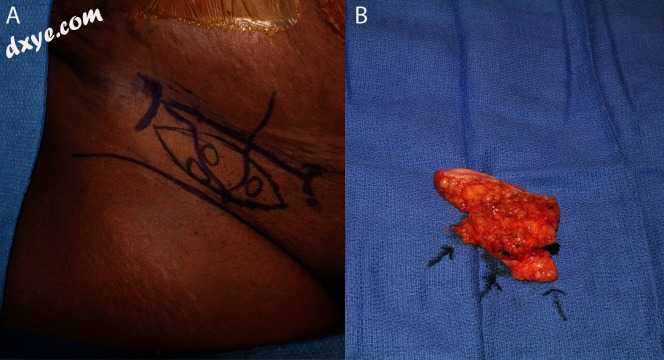
图3
基于腹股沟的淋巴瓣的皮肤标记,淋巴闪烁成像和ICG(A)确定淋巴结。切开的皮瓣用箭头表示淋巴结(B)。
目前存在关于VLNT如何治疗淋巴水肿的两种理论。一种理论认为淋巴管生成是通过移植的淋巴结产生的生长因子发生的,新的淋巴管能够重建淋巴通路(1,45)。另一种理论认为,转移的血管化淋巴结起淋巴泵的作用:动脉吻合术作为泵的脉动和皮瓣静脉输出的抽吸作用的组合,为通过移植的淋巴结引起淋巴引流创造了动力(1, 44,46)。目前缺乏这些机制的组织学,成像或生理学证据阻止了这两种理论的确定性验证。但是,Chong等人。最近开发了一种通过使用红外成像可视化小鼠淋巴管收缩性的方法,该方法可用于揭示未来VLNT背后的潜在机制(47)。
许多研究已证实使用简单的显微外科手术VLNT治疗淋巴水肿,其中一些显示优于LVA的结果(1,48-51)。尽管其有效,VLNT并不总是导致最佳的淋巴流出,并且还构成游离皮瓣手术,其可能涉及显著的供体部位发病率。然而,技术的进步和改进旨在减少这些缺点。 Visconti等。已经描述了使用超微外科穿支 - 穿支吻合术在大鼠中成功使用新的颈淋巴结 - 脂肪 - 皮瓣,Yamamoto等。最近报道了使用穿支 - 穿支吻合术和供体和受体淋巴管之间的传出淋巴管淋巴吻合术来使用VLNT(52,53)。此外,一些外科医生将LVA与VLNT结合,将传出淋巴管与皮瓣内或皮瓣附近的流出静脉吻合,以改善植入组织的淋巴引流(52)。继续试验改善淋巴引流的技术以及对最佳供体和受体部位的进一步研究将有可能改善患者的治疗效果,并支持更多常规使用该方法治疗淋巴水肿。
软组织重建
尽管使用穿支皮瓣进行显微手术游离组织重建,功能和美学效果得到改善,但该过程仍然存在危及主要血管的风险,涉及长时间操作,并且可能导致显著的供体部位发病率和瘢痕形成(54-56)。在接受部位提升真正的穿支皮瓣和进行穿支 - 穿支吻合术的超微外科技术可以帮助解决许多这些问题。因此,超微外科手术越来越多地用于下肢,颅面,手部和乳房重建(17,19,57,58)。
超微外科重建的主要优点是它允许使用真正的穿支进行吻合术,由Wei等人定义。作为皮肤血管,在其过程中刺穿深筋膜,最终到达皮肤(59)。超微外科手术的利用通过仅解剖最浅表的穿支而形成非常薄的皮瓣;图4显示了使用薄的浅表环形髂骨穿支(SCIP)皮瓣重建跟腱上的小缺损。这些薄的真正的穿支皮瓣减少了供体部位的发病率,因为在超筋膜平面切割有助于保留肌肉,筋膜,皮肤神经和主要血管(60)。另外,由于这些真正的穿支皮瓣的蒂较短,因此解剖时间较短,并且减少了在手术室中花费的时间(4)。最后,对穿支理论的阐述,穿支在整个身体中的映射以及术前成像用于定位穿支的使用为外科医生在选择最适合重建的特定供体部位方面提供了更大的灵活性(54)。已经描述了用于超微外科吻合术的几种穿支皮瓣,包括胸背,胸外侧,拇趾浅表,脐旁,前外侧大腿和臀动脉穿支皮瓣(60)。
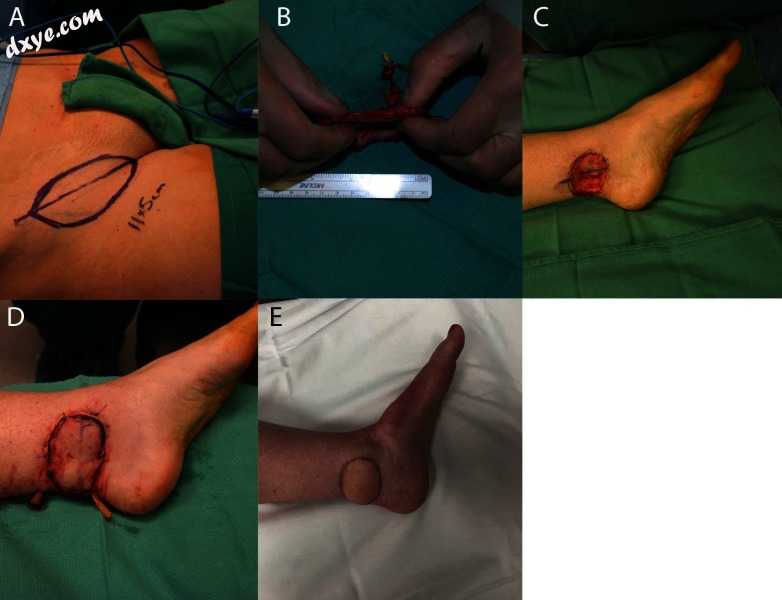
图4
(A)显示SCIP皮瓣的标记,(B)显示薄切开的皮瓣。 (C)显示受体伤口床,(D)显示皮瓣就位的受体部位。 (E)术后3个月显示相同的足部。
使用穿支作为接收器也具有几个优点。首先,在身体的甚至小区域内可用的大量穿支允许增加对接收血管(15)的选择的选择。当较大血管存在于损伤区域内,或者需要彻底解剖以暴露深血管时,这尤其有用,因此增加了受体部位发病的风险。穿支 - 穿支吻合术对于患有显著动脉粥样硬化或其他病症的患者也是有用的,导致供应腿部的主要血管较少。例如,超微外科手术通过使用缺血区域的侧支血管作为受体血管,越来越多地用于糖尿病足重建(7,61)。在这种情况下,接受者穿支可用于执行游离瓣覆盖而不损害远端流动(图5)。最后,穿支 - 穿支吻合术也对皮瓣挽救有影响,为绕过充血或血栓形成区域提供了额外的选择(23,62,63)。
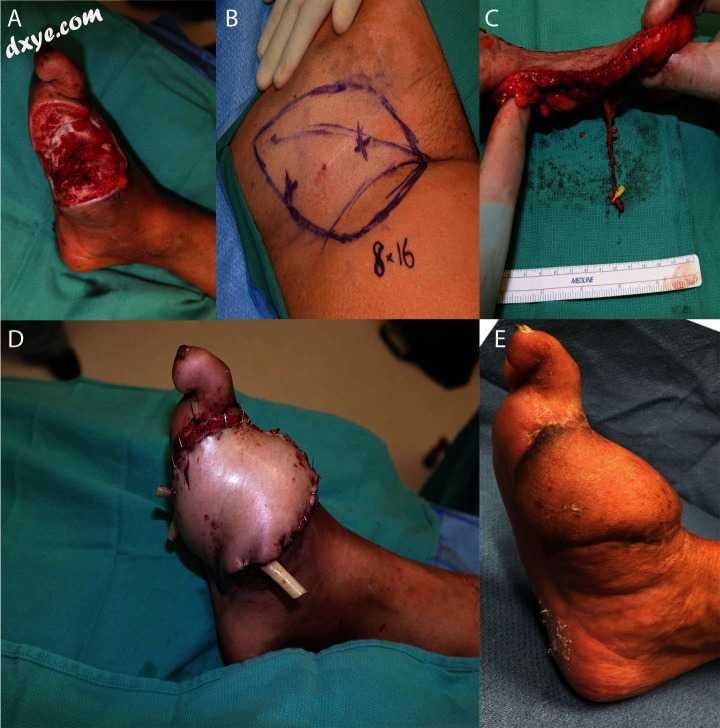
图5
抢救糖尿病伤口。患者出现感染的大脚趾截肢,并进行了三阶段的截骨术清创术。 (A)显示软组织重建前的缺损,(B)显示SCIP皮瓣的标记,(C)显示切开的皮瓣和血管,(D)显示插入后的皮瓣。 (E)术后6个月显示皮瓣。
尽管超微外科软组织重建提供了益处,但该技术具有其局限性。首先,假设小穿孔血管发生血栓形成的概率增加,这导致皮瓣坏死(64)。此外,许多机构没有配备执行超微外科手术所需的技术,包括能够放大50倍的强大显微镜,精细手术器械和穿支绘图所需的成像技术,包括多排计算机断层扫描,磁共振成像和近红外吲哚菁绿荧光成像(65-67)。最后,由于皮瓣蒂的长度较短以及难以预先形成小血管的吻合,该技术需要很长时间才能掌握。
手外科
在超微外科研究中受到重视的一个领域是手外科手术。超微外科手术是手部重建的理想选择,因为指尖的精致解剖结构需要使用非常精细的手术器械和缝合线。此外,为了安全地重建远端手指,需要超微外科技能,因为在该位置的血管口径通常小于0.5mm(68)。 超显微外科已成功用于指尖再植,趾尖转移,游离指甲皮瓣和游离穿支皮瓣(24,68-70)。
随着超微外科手术的出现,指尖再植现在用于指截肢,以便在恢复功能,长度和美观的同时避免疼痛的残端神经瘤(71)。指尖再植的积极结果已在文献中得到验证;例如,Hattori等人的一项研究。研究发现,再植成功的患者有更大的运动范围,更少的疼痛,更好的手臂,肩膀和手部残疾(DASH)评分,并且与接受截肢和翻修的患者相比更为满意(72)。尽管如此,许多手外科医生认为这些技术上具有挑战性,冗长的手术对修复截肢提供的功能改善很少,并且在截肢指尖受到严重损伤的挤压伤中,再植的成功率可能会降低(68)。
通过使用超微外科手术(69,73,74),还可以通过游离组织瓣进行指尖重建,包括各种穿支,指甲和脚趾皮瓣。这些程序通常保留用于远端指尖不可用或太严重损伤以用于再植的情况。新的皮瓣的开发和改进,例如背桡穿孔(DRAP),桡动脉浅表掌(SUPBRA)和足内侧皮瓣,允许在局部麻醉下进行单阶段指尖重建,最小的供体部位瘢痕形成。这些穿孔皮瓣受到神经支配,可以恢复一些感官功能,同时保留美学效果,包括皮肤纹理和颜色(69,75,76)。随着超微外科手术越来越多地融入手外科领域,引入额外的皮瓣和改进现有技术可以允许皮瓣重建在不可能再植的情况下完全恢复指功能。
其他应用
超微外科手术的一个主要好处是能够以更精细的尺度操纵结构,允许对非常精细的身体部位进行精确和有机的重建。例如,成功再植部分截肢的鼻节段已经取得了很高的成功率(77,78)。此外,通过超微外科技术使用耳螺旋瓣进行上眼睑的重建,并且先前已经使用超微外科手术成功地进行了舌重建(18,79)。最后,尿道重建可以使用超微外科手术,使用阑尾转移或更传统的游离皮瓣进行(80,81)。这些程序强调了超微外科手术在进一步扩大微血管手术范围方面的重要性,几乎可以成功地重建身体的每个部位。
随着超微外科技术的出现,微血管美容手术也得到了丰富。特别是,穿支无脂肪皮瓣已被充分描述用于面部和隆胸,据报道美学效果大于游离脂肪注射和传统的真皮脂肪皮瓣(5)。使用皮瓣进行美观手术也使外科医生在手术过程中具有显著的灵活性;例如,如果需要减少体积大的脂肪,可以很容易地将用于乳房重建的脐旁穿支脂肪皮瓣脱脂,这种技术可以使用各种穿孔血管,并且可以根据患者的特定需要提升和定制许多皮瓣。取决于缺陷的形状和大小(82)。根据Koshima等人的说法,利用超微外科手术治疗面部和隆胸的脐旁穿孔皮瓣特别适用于未来可能怀孕的年轻女性,因为腹部的供体部位发病率很低,而且进一步骨骼增长的可能性(82)。
超微外科手术也有助于微神经修复的创新。 2010年,Koshima等人。利用超微外科技术引入了一种新的周围神经修复方法,他称之为束状翻转皮瓣。该过程首先涉及从神经间隙的近端或远端分离和接合单个神经束。然后将神经束翻过神经间隙并抵靠对侧神经末端,缝合束状皮瓣和对侧神经干。对于较大的神经间隙,可以沿着神经间隙的中间部分缝合来自近端和远端神经干的双侧翻转束状皮瓣(83)。据信轴突流最终通过轴突发芽重建(83,84)。尽管在他们的实验中没有使用对照,但是Koshima等人。报道了与血管神经移植方法相比,指神经修复中束状翻转皮瓣的良好感觉恢复,以及更快的手术时间和更少的侵入性手术(4,5,83,85)。
超微外科训练
虽然大多数整形外科住院医师计划教授显微手术技术,但超显微手术需要更高的技能水平,用于眼睛显微镜手部协调,更灵巧的组织处理,以及比显微手术更精细的运动技能(86)。这些技术技能需要经过培训和广泛实践,以便在手术室中得到适当的利用。
手术模拟训练有助于通过重复发展重要的精神运动,技术和判断技能,并提供机会从一个人的错误中吸取教训而不会造成重大伤害(87)。由于超微外科手术是少数外科医生实施的新技术,因此对手术模拟器和训练模型的需求增加,以促进技能的快速获取。目前,存在几种用于训练超微外科技术的模拟器,包括合成和生物非生物模拟器,以及活动物模型(64)。
建议使用合成模型来获取基本的超微外科技能,例如学习微观调整和手术工具的处理。最基本的型号包括练习卡,其中包含直径小于0.8毫米的固定硅管,可用于练习超微外科口径血管的吻合术(88)。这些练习卡附在显微镜的舞台上,可以使用临床使用的显微外科手术器械进行操作。更高保真的生物尸体模型,例如Chen等人介绍的鸡大腿模型,一旦获得基本技能并且受训者使用显微镜和相关仪器,就可以用于高级技能获取(86)。在鸡大腿模型中,坐骨神经动脉和静脉的分支直径在0.3-0.5mm之间,允许在生物亚毫米血管上练习。非生命生物模型的一个主要好处是,受训者可以获得与人类患者中执行的程序几乎相同的触觉反馈。这些模型具有成本效益,不需要术前或术后护理(86)。
一旦使用非生命模型充分发展超微外科技能,受训者就可以进步到活体动物模型上练习。几种具有各种亚毫米血管的活体老鼠模型可用于超微外科技术的实践(89-92)。不同的模型允许练习各种各样的技术,从简单的穿支到穿支吻合术到完整的皮瓣转移。一旦外科医生精通在活动物模型上执行这些技能,他或她就可以准备好在患者护理中利用这些技术。
机器人辅助手术作为一种有效的技术
超微外科手术面临的最大挑战之一是成功吻合所需的高灵活性和手术控制。机器人辅助手术(RAS),定义为由人类外科医生通过使用机器人仪器执行的手术,可以促进该技术的使用。尽管RAS已经被用于执行需要操纵小结构的非常精细的外科手术,但目前文献中只有一项研究描述了使用达芬奇手术系统进行成功的超微外科手术(93)。
RAS提供了几项独特的优势,可以帮助外科医生执行该技术并增强超微外科手术。首先,达芬奇可以对仪器进行高精度控制,可以在整个过程中不断调整,从而提高操作员动作的准确性。此外,达芬奇手术系统允许外科医生在传统手术中难以接近的解剖区域工作;这可以为外科医生在手术期间提供更大的人体工程学舒适度并且允许额外的操作角度。最后,RAS可以完全抑制普通手震,进一步提高手术动作的精确度(93)。因此,RAS可以使用超微外科手术。
然而,RAS的使用需要增加的操作时间,昂贵,并且通过RAS执行的运动和动作的所有组件比可由人手执行的那些更有限。因此,经验丰富的外科医生使用RAS可能会被保留用于需要超出常规程序所需的极其微妙的超微外科技术以及从远处进行远程控制手术的程序(93)。尽管如此,RAS代表了超微外科的一个令人兴奋的新前沿,可能是未来操纵更小的解剖结构的关键。
未来发展方向
器官移植
目前正在研究使用超微外科技术在动物模型中进行肢体移植,子宫移植和眼移植(92,94,95)。 Kisu等人。最近报道了通过髂内动脉和浅表子宫静脉与其相应的受体血管吻合,在食蟹猴成功进行子宫移植中使用超微外科手术(94)。该程序的成功突出了超微外科手术用于移植具有先前不适合显微外科手术的小进食器官的器官的重要性。在Sucher等人的大鼠动物模型中进行的肢体移植手术中说明了类似的原理。 (92)。可以想象,生物工程的身体部位在未来也可能严重依赖于超微外科技术。
定制重建
越来越多地使用超微外科手术在软组织重建中的一个令人兴奋的结果是可以提高定制的皮瓣以适应个人的重建需求。由于超微外科手术允许外科医生使用来自全身的薄皮瓣而且供体部位发病率最低,因此根据所需的特定颜色,大小,三维形状,血液供应和神经支配模式设计皮瓣变得越来越可能。因此,超微外科手术的进一步完善和新皮瓣类型的实验可以允许外科医生进行高度定制的重建,从而改善具有复杂重建需求的患者的美学和功能结果(4)。
随着穿支皮瓣的出现,“喜欢与之相似”的重建概念已经开始受到关注,但超微外科手术为真正个性化的游离式穿支皮瓣打开了大门,基于重建的需要。文献中有一些研究描述了用于精确重建软组织缺损的定制穿支皮瓣的实验(96,97)。例如,Jin等人。最近报道了他们使用超微外科手术与SCIP皮瓣进行类似颊侧重建的经验;作者报告设计了具有表面积和体积的皮瓣,以满足受体口腔缺陷的美容和功能要求。使用这个程序,作者描述了口腔区域的优秀美学和功能结果,成功的类似重建,以及最小的供体部位瘢痕形成(96)。
堆叠的穿支游离皮瓣代表了超微外科手术解决复杂重建问题的另一个机会。皮瓣的“堆叠”涉及将组织从多个供体部位转移到单个受体部位,这种技术先前已描述用于需要额外体积以实现最佳结果的患者的乳房重建。堆叠的深下腹壁穿支(DIEP)皮瓣,深层动脉穿支皮瓣,浅表下腹壁动脉(SIEA)皮瓣和其他几种组合已被用于此目的(98,99)。尽管这些程序通常产生了成功的重建结果,但它们仍然涉及显著的受体和供体部位发病率,特别是如果使用双侧供体部位。超微外科手术可以通过允许更自由地选择供体和受体血管进行吻合来增强堆叠皮瓣的效用;例如,可以设想使用小的肋间或内乳房穿支作为用于使用穿支 - 穿支吻合术的堆叠穿支瓣的接收器,或者使用主要游离瓣的供给穿刺容器作为第二瓣通过内部的接收器-瓣吻合术(99-102)。这些技术可以通过消除对大血管解剖的需要来减少供体和受体部位的发病率。
超微外科手术也可以应用于嵌合皮瓣的概念,其由各种不同组织类型的单独皮瓣组成,这些皮瓣通过单个血管蒂相互连接。它们可以进一步分解成那些通过其内在脉管系统连接的嵌合皮瓣和通过微吻合术连接的预制皮瓣。通过允许不同组织类型的转移和每个组件的独立插入,嵌合皮瓣产生大的空间自由度,以恢复复杂三维缺陷的体积和轮廓(103)。超微外科手术允许解剖和使用独特的内在嵌合皮瓣,依赖于不适合传统显微外科手术的小型滋养血管,以重建复杂的缺损;例如,Yamamoto等人。之前已经描述过使用四重组分内在嵌合SCIP皮瓣,其中包括Sartorius肌肉,深筋膜,腹股沟淋巴结和皮肤/脂肪的部分,用于复杂的踝关节重建(104)。费尔南德斯加里多等人。类似地描述了嵌合SCIP皮瓣的使用,其中一块外部斜肌筋膜被定制以重建背足缺损(105)。随着技术的进一步改进,超微外科手术可以允许使用来自全身的组织预制高度定制的多组分嵌合皮瓣,而不受供血血管尺寸的限制,这可以精确地适应患者的重建需求。
极端抢救
超微外科手术的一个重要应用是在严重的全身或局部疾病的情况下挽救四肢的能力。通过使用超微外科技术,可以在以前限制简单显微外科组织转移的条件下进行极端肢体抢救,包括肾功能衰竭,免疫抑制药物移植后患者,严重糖尿病微血管疾病,晚期外周血管疾病严重缺血,截肢史。在这些情况下,伤口愈合受损,循环不良,主要血管经常钙化,使显微外科手术极为困难(61,106)。通过超微外科手术,在慢性缺血环境中形成的小侧支血管,或在下肢严重创伤后留下的小穿支,可用作游离组织吻合的受体血管而不损害远端血流(19,61)。因此,即使是由于受伤或晚期缺血而来自主要血管的血管流量差的极度病患者,只要他们具有足够脉冲的小动脉,就可以给予重建机会。例如,Suh等人。研究表明,患有缺血性糖尿病足溃疡和显著合并症(包括肾功能衰竭,免疫抑制和既往截肢)的患者可以在不同的血管区域使用小的受体末端动脉或穿支进行下肢重建,报告的总体保肢率为90.5 %(7)。对于严重受伤和多种合并症的患者,超微外科手术是避免肢体截肢的最佳选择。
结论
超微外科手术极大地扩展了可在显微镜下进行的手术范围。由于小血管的吻合是许多手术的核心组成部分,超微外科手术对各种不同的手术产生了巨大的影响,从淋巴水肿管理到软组织重建,指再植和美容手术。重要的是,超微外科是一个全新的领域,并且只有在2010年才能达成共识(4)。因此,可以肯定的是,该领域将在未来几年继续看到其他创新,改进和采用。目标是随着技术的进一步创新和完善,超微外科设备将扩大,操作时间将缩短,学习曲线将减少,患者结果将得到改善。
现在需要基于结果的研究来调查超微外科手术后的功能结果和患者满意度。利用这些研究的结果,当面临重建中的具有挑战性的病例时,可以在临床决策算法中正式采用超微外科手术。为了增加这些技术的广泛采用,必须开发专门用于超微外科手术的其他模拟模型和培训计划。
参考:
Supermicrosurgery: History, Applications, Training and the Future
1. Raju A, Chang DW. Vascularized lymph node transfer for treatment of lymphedema: a comprehensive literature review. Ann Surg (2015) 261(5):1013–23. 10.1097/SLA.0000000000000763 [PubMed] [CrossRef] [Google Scholar]
2. Tashiro K, Harima M, Yamamoto T, Narushima M, Koshima I. Locating recipient perforators for perforator-to-perforator anastomosis using color doppler ultrasonography. J Plast Reconstr Aesthet Surg (2014) 67(12):1680–3. 10.1016/j.bjps.2014.08.047 [PubMed] [CrossRef] [Google Scholar]
3. Park JE, Chang DW. Advances and innovations in microsurgery. Plast Reconstr Surg (2016) 138(5):915e–24. 10.1097/PRS.0000000000002715 [PubMed] [CrossRef] [Google Scholar]
4. Masia J, Olivares L, Koshima I, Teo TC, Suominen S, van Landuyt K, et al. Barcelona consensus on supermicrosurgery. J Reconstr Microsurg (2014) 30(1):53–8. 10.1055/s-0033-1354742 [PubMed] [CrossRef] [Google Scholar]
5. Koshima I, Yamamoto T, Narushima M, Mihara M, Iida T. Perforator flaps and supermicrosurgery. Clin Plast Surg (2010) 37(4):683–9. 10.1016/j.cps.2010.06.009 [PubMed] [CrossRef] [Google Scholar]
6. Yamamoto T, Yamamoto N, Ishiura R. Thirty-micron needle for precise supermicrosurgery. Microsurgery (2017) 37(6):735–6. 10.1002/micr.30165 [PubMed] [CrossRef] [Google Scholar]
7. Suh HS, Oh TS, Lee HS, Lee SH, Cho YP, Park JR, et al. A new approach for reconstruction of diabetic foot wounds using the angiosome and supermicrosurgery concept. Plast Reconstr Surg (2016) 138(4):702e–9. 10.1097/PRS.0000000000002401 [PubMed] [CrossRef] [Google Scholar]
8. Mihara M, Hara H, Tange S, Zhou HP, Kawahara M, Shimizu Y, et al. Multisite lymphaticovenular bypass using supermicrosurgery technique for lymphedema management in lower lymphedema cases. Plast Reconstr Surg (2016) 138(1):262–72. 10.1097/PRS.0000000000002254 [PubMed] [CrossRef] [Google Scholar]
9. Burns PB, Rohrich RJ, Chung KC. The levels of evidence and their role in evidence-based medicine. Plast Reconstr Surg (2011) 128(1):305–10. 10.1097/PRS.0b013e318219c171 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
10. Tamai S. History of microsurgery. Plast Reconstr Surg (2009) 124(6 Suppl):e282–94. 10.1097/PRS.0b013e3181bf825e [PubMed] [CrossRef] [Google Scholar]
11. Jacobson JH, Suarez EL. Microsurgery in anastomosis of small vessels. Surg Forum (1960) 11:243–5. [Google Scholar]
12. Malt RA, Mckhann C. Replantation of severed arms. JAMA (1964) 189:716–22. 10.1001/jama.1964.03070100010002 [PubMed] [CrossRef] [Google Scholar]
13. Taylor GI, Palmer JH. The vascular territories (angiosomes) of the body: experimental study and clinical applications. Br J Plast Surg (1987) 40(2):113–41. 10.1016/0007-1226(87)90185-8 [PubMed] [CrossRef] [Google Scholar]
14. Koshima I, Soeda S. Inferior epigastric artery skin flaps without rectus abdominis muscle. Br J Plast Surg (1989) 42(6):645–8. 10.1016/0007-1226(89)90075-1 [PubMed] [CrossRef] [Google Scholar]
15. Saint-Cyr M, Wong C, Schaverien M, Mojallal A, Rohrich RJ. The perforasome theory: vascular anatomy and clinical implications. Plast Reconstr Surg (2009) 124(5):1529–44. 10.1097/PRS.0b013e3181b98a6c [PubMed] [CrossRef] [Google Scholar]
16. Koshima I, Inagawa K, Urushibara K, Moriguchi T. Paraumbilical perforator flap without deep inferior epigastric vessels. Plast Reconstr Surg (1998) 102(4):1052–7. 10.1097/00006534-199809020-00020 [PubMed] [CrossRef] [Google Scholar]
17. Kompatscher P, Manestar M, Schuster A, Lang A, Beer GM. The thoracoacromial vessels as recipient vessels in microsurgery and supermicrosurgery: an anatomical and sonographic study. Plast Reconstr Surg (2005) 115(1):77–83. [PubMed] [Google Scholar]
18. Kim JS, Choi TH, Kim NG, Lee KS, Han KH, Son DG, et al. The replantation of an amputated tongue by supermicrosurgery. J Plast Reconstr Aesthet Surg (2007) 60(10):1152–5. 10.1016/j.bjps.2007.01.009 [PubMed] [CrossRef] [Google Scholar]
19. Hong JP. The use of supermicrosurgery in lower extremity reconstruction: the next step in evolution. Plast Reconstr Surg (2009) 123(1):230–5. 10.1097/PRS.0b013e3181904dc4 [PubMed] [CrossRef] [Google Scholar]
20. Koshima I, Nanba Y, Tsutsui T, Takahashi Y. Medial plantar perforator flaps with supermicrosurgery. Clin Plast Surg (2003) 30(3):447–55. 10.1016/S0094-1298(03)00044-0 [PubMed] [CrossRef] [Google Scholar]
21. Koshima I, Nanba Y, Tsutsui T, Takahashi Y, Itoh S, Fujitsu M. Minimal invasive lymphaticovenular anastomosis under local anesthesia for leg lymphedema: is it effective for stage III and IV? Ann Plast Surg (2004) 53(3):261–6. [PubMed] [Google Scholar]
22. Felmerer G, Sattler T, Lohrmann C, Tobbia D. Treatment of various secondary lymphedemas by microsurgical lymph vessel transplantation. Microsurgery (2012) 32(3):171–7. 10.1002/micr.20968 [PubMed] [CrossRef] [Google Scholar]
23. Hong JP, Koshima I. Using perforators as recipient vessels (supermicrosurgery) for free flap reconstruction of the knee region. Ann Plast Surg (2010) 64(3):291–3. 10.1097/SAP.0b013e3181ac4263 [PubMed] [CrossRef] [Google Scholar]
24. Kim JS, Yang JW, Lee DC, Ki SH, Roh SY. Challenges in fingertip replantation. Semin Plast Surg (2013) 27(4):165–73. 10.1055/s-0033-1360583 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
25. Patel KM, Manrique O, Sosin M, Hashmi MA, Poysophon P, Henderson R. Lymphatic mapping and lymphedema surgery in the breast cancer patient. Gland Surg (2015) 4(3):244–56. 10.3978/j.issn.2227-684X.2015.03.02 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
26. Symvoulakis EK, Anyfantakis DI, Lionis C. Primary lower limb lymphedema: a focus on its functional, social and emotional impact. Int J Med Sci (2010) 7(6):353–7. 10.7150/ijms.7.353 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
27. Johansson K, Holmström H, Nilsson I, Ingvar C, Albertsson M, Ekdahl C. Breast cancer patients' experiences of lymphoedema. Scand J Caring Sci (2003) 17(1):35–42. 10.1046/j.1471-6712.2003.00119.x [PubMed] [CrossRef] [Google Scholar]
28. Passik SD, Mcdonald MV. Psychosocial aspects of upper extremity lymphedema in women treated for breast carcinoma. Cancer (1998) 83(12 Suppl American):2817–20. 10.1002/(SICI)1097-0142(19981215)83:12B+<2817::AID-CNCR32>3.0.CO;2-2 [PubMed] [CrossRef] [Google Scholar]
29. Ahmed RL, Prizment A, Lazovich D, Schmitz KH, Folsom AR. Lymphedema and quality of life in breast cancer survivors: the Iowa women's health study. J Clin Oncol (2008) 26(35):5689–96. 10.1200/JCO.2008.16.4731 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
30. Taghian NR, Miller CL, Jammallo LS, O'Toole J, Skolny MN. Lymphedema following breast cancer treatment and impact on quality of life: a review. Crit Rev Oncol Hematol (2014) 92(3):227–34. 10.1016/j.critrevonc.2014.06.004 [PubMed] [CrossRef] [Google Scholar]
31. Demirtas Y, Ozturk N, Yapici O, Topalan M. Comparison of primary and secondary lower-extremity lymphedema treated with supermicrosurgical lymphaticovenous anastomosis and lymphaticovenous implantation. J Reconstr Microsurg (2010) 26(2):137–43. 10.1055/s-0029-1243299 [PubMed] [CrossRef] [Google Scholar]
32. Yamamoto T, Yoshimatsu H, Yamamoto N, Narushima M, Iida T, Koshima I. Side-to-end Lymphaticovenular anastomosis through temporary lymphatic expansion. PLoS ONE (2013) 8(3):e59523 10.1371/journal.pone.0059523 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
33. Koshima I, Inagawa K, Urushibara K, Moriguchi T. Supermicrosurgical lymphaticovenular anastomosis for the treatment of lymphedema in the upper extremities. J Reconstr Microsurg (2000) 16(6):437–42. 10.1055/s-2006-947150 [PubMed] [CrossRef] [Google Scholar]
34. Auba C, Marre D, Rodríguez-Losada G, Hontanilla B. Lymphaticovenular anastomoses for lymphedema treatment: 18 months postoperative outcomes. Microsurgery (2012) 32(4):261–8. 10.1002/micr.20980 [PubMed] [CrossRef] [Google Scholar]
35. Campisi C, Bellini C, Campisi C, Accogli S, Bonioli E, Boccardo F. Microsurgery for lymphedema: clinical research and long-term results. Microsurgery (2010) 30(4):256–60. 10.1002/micr.20737 [PubMed] [CrossRef] [Google Scholar]
36. Chang DW. Lymphaticovenular bypass for lymphedema management in breast cancer patients: a prospective study. Plast Reconstr Surg (2010) 126(3):752–8. 10.1097/PRS.0b013e3181e5f6a9 [PubMed] [CrossRef] [Google Scholar]
37. Campisi C, Davini D, Bellini C, Taddei G, Villa G, Fulcheri E, et al. Lymphatic microsurgery for the treatment of lymphedema. Microsurgery (2006) 26(1):65–9. 10.1002/micr.20214 [PubMed] [CrossRef] [Google Scholar]
38. Chang DW, Suami H, Skoracki R. A prospective analysis of 100 consecutive lymphovenous bypass cases for treatment of extremity lymphedema. Plast Reconstr Surg (2013) 132(5):1305–14. 10.1097/PRS.0b013e3182a4d626 [PubMed] [CrossRef] [Google Scholar]
39. Matsutani H, Hayashi A, Yamamoto T. All-star lymphatic supermicrosurgery: multiple lymph flow diversion using end-to-end, end-to-side, side-to-end, and side-to-side lymphaticovenular anastomoses in a surgical field. Journal of Plastic, Reconstructive & Aesthetic Surgery (2015) 68(5):e107–108. 10.1016/j.bjps.2015.02.022 [PubMed] [CrossRef] [Google Scholar]
40. Silva AK, Chang DW. Vascularized lymph node transfer and lymphovenous bypass: novel treatment strategies for symptomatic lymphedema. J Surg Oncol (2016) 113(8):932–9. 10.1002/jso.24171 [PubMed] [CrossRef] [Google Scholar]
41. Damstra RJ, Voesten HG, van Schelven WD, van der Lei B, Anastomosis Lvenous. Lymphatic venous anastomosis (LVA) for treatment of secondary arm lymphedema. A prospective study of 11 LVA procedures in 10 patients with breast cancer related lymphedema and a critical review of the literature. Breast Cancer Res Treat (2009) 113(2):199–206. 10.1007/s10549-008-9932-5 [PubMed] [CrossRef] [Google Scholar]
42. Scaglioni MF, Arvanitakis M, Chen YC, Giovanoli P, Chia-Shen Yang J, Chang EI. Comprehensive review of vascularized lymph node transfers for lymphedema: outcomes and complications. Microsurgery (2018) 38(2):222-229–229. 10.1002/micr.30079 [PubMed] [CrossRef] [Google Scholar]
43. Becker C, Assouad J, Riquet M, Hidden G. Postmastectomy Lymphedema. Ann Surg (2006) 243(3):313–5. 10.1097/01.sla.0000201258.10304.16 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
44. Lin CH, Ali R, Chen SC, Wallace C, Chang YC, Chen HC, et al. Vascularized groin lymph node transfer using the wrist as a recipient site for management of postmastectomy upper extremity lymphedema. Plast Reconstr Surg (2009) 123(4):1265–75. 10.1097/PRS.0b013e31819e6529 [PubMed] [CrossRef] [Google Scholar]
45. Becker C, Vasile JV, Levine JL, Batista BN, Studinger RM, Chen CM, et al. Microlymphatic surgery for the treatment of iatrogenic lymphedema. Clin Plast Surg (2012) 39(4):385–98. 10.1016/j.cps.2012.08.002 [PubMed] [CrossRef] [Google Scholar]
46. Cheng MH, Huang JJ, Huang JJ, Nguyen DH, Saint-Cyr M, Zenn MR, et al. A novel approach to the treatment of lower extremity lymphedema by transferring a vascularized submental lymph node flap to the ankle. Gynecol Oncol (2012) 126(1):93–8. 10.1016/j.ygyno.2012.04.017 [PubMed] [CrossRef] [Google Scholar]
47. Chong C, Scholkmann F, Bachmann SB, Luciani P, Leroux JC, Detmar M, et al. In vivo visualization and quantification of collecting lymphatic vessel contractility using near-infrared imaging. Sci Rep (2016) 6(6):srep22930 10.1038/srep22930 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
48. Tobbia D, Semple J, Baker A, Dumont D, Johnston M. Experimental assessment of autologous lymph node transplantation as treatment of postsurgical lymphedema. Plast Reconstr Surg (2009) 124(3):777–86. 10.1097/PRS.0b013e3181b03787 [PubMed] [CrossRef] [Google Scholar]
49. Batista BN, Germain M, Faria JC, Becker C. Lymph node flap transfer for patients with secondary lower limb lymphedema. Microsurgery (2017) 37(1):29–33. 10.1002/micr.22404 [PubMed] [CrossRef] [Google Scholar]
50. Akita S, Mitsukawa N, Kuriyama M, Kubota Y, Hasegawa M, Tokumoto H, et al. Comparison of vascularized supraclavicular lymph node transfer and lymphaticovenular anastomosis for advanced stage lower extremity lymphedema. Ann Plast Surg (2015) 74(5):1–9. 10.1097/SAP.0000000000000513 [PubMed] [CrossRef] [Google Scholar]
51. Granzow JW, Soderberg JM, Kaji AH, Dauphine C. An effective system of surgical treatment of lymphedema. Ann Surg Oncol (2014) 21(4):1189–94. 10.1245/s10434-014-3515-y [PubMed] [CrossRef] [Google Scholar]
52. Yamamoto T, Yoshimatsu H, Yamamoto N. Complete lymph flow reconstruction: a free vascularized lymph node true perforator flap transfer with efferent lymphaticolymphatic anastomosis. J Plast Reconstr Aesthet Surg (2016) 69(9):1227–33. 10.1016/j.bjps.2016.06.028 [PubMed] [CrossRef] [Google Scholar]
53. Visconti G, Brunelli C, Mulè A, Franceschini G, Chen HC, Masetti R, et al. Septum-based cervical lymph-node free flap in rat: a new model. J Surg Res (2016) 201(1):1–12. 10.1016/j.jss.2015.09.027 [PubMed] [CrossRef] [Google Scholar]
54. Engel H, Gazyakan E, Cheng MH, Piel D, Germann G, Giessler G. Customized reconstruction with the free anterolateral thigh perforator flap. Microsurgery (2008) 28(7):489–94. 10.1002/micr.20538 [PubMed] [CrossRef] [Google Scholar]
55. di Candia M, Lie K, Kumiponjera D, Simcock J, Cormack GC, Malata CM. Versatility of the anterolateral thigh free flap: the four seasons flap. Eplasty (2012) 12:e21. [PMC free article] [PubMed] [Google Scholar]
56. Weckx A, Loomans N, Lenssen O. Perforator free flaps in head and neck reconstruction: a single-center low-volume experience. Oral Surg Oral Med Oral Pathol Oral Radiol (2017) 123(4):429–35. 10.1016/j.oooo.2016.11.010 [PubMed] [CrossRef] [Google Scholar]
57. Choi DH, Goh T, Cho JY, Hong JP. Thin superficial circumflex iliac artery perforator flap and supermicrosurgery technique for face reconstruction. J Craniofac Surg (2014) 25(6):1–3. 10.1097/SCS.0000000000001093 [PubMed] [CrossRef] [Google Scholar]
58. Yoon CS, Noh HJ, Malzone G, Suh HS, Choi DH, Hong JP. Posterior interosseous artery perforator-free flap: treating intermediate-size hand and foot defects. J Plast Reconstr Aesthet Surg (2014) 67(6):808–14. 10.1016/j.bjps.2014.03.007 [PubMed] [CrossRef] [Google Scholar]
59. Wei FC, Jain V, Suominen S, Chen HC. Confusion among perforator flaps: what is a true perforator flap? Plast Reconstr Surg (2001) 107(3):874–6. 10.1097/00006534-200103000-00037 [PubMed] [CrossRef] [Google Scholar]
60. Ozkan O, Koshima I, Gonda K. A supermicrosurgical flap model in the rat: a free true abdominal perforator flap with a short pedicle. Plast Reconstr Surg (2006) 117(2):479–85. 10.1097/01.prs.0000197215.94170.b8 [PubMed] [CrossRef] [Google Scholar]
61. Suh HS, Oh TS, Hong JP. Innovations in diabetic foot reconstruction using supermicrosurgery. Diabetes Metab Res Rev (2016) 32(Suppl 1):275–80. 10.1002/dmrr.2755 [PubMed] [CrossRef] [Google Scholar]
62. Hwang KT, Kim WH, Kim JT, Kim YH. Perforator flap salvage using supermicrosurgical division and diversion of the pedicle. J Plast Reconstr Aesthet Surg (2013) 66(4):585–7. 10.1016/j.bjps.2012.09.021 [PubMed] [CrossRef] [Google Scholar]
63. Defazio MV, Abbate OA, Lakhiani C, Song DH. Pedicle-to-perforator bypass using supermicrosurgical technique for deep inferior epigastric artery perforator flap salvage. Plast Reconstr Surg Glob Open (2017) 5(10):e1542 10.1097/GOX.0000000000001542 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
64. Bas CE, Cwykiel J, Siemionow M. A new supermicrosurgery training model of saphenous artery and great saphenous vein anastomosis for development of advanced microsurgical skills. J Reconstr Microsurg (2017) 33(6):426–34. 10.1055/s-0037-1599101 [PubMed] [CrossRef] [Google Scholar]
65. Lee BT, Matsui A, Hutteman M, Lin SJ, Winer JH, Laurence RG, et al. Intraoperative near-infrared fluorescence imaging in perforator flap reconstruction: current research and early clinical experience. J Reconstr Microsurg (2010) 26(1):059–65. 10.1055/s-0029-1244805 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
66. Masia J, Navarro C, Clavero JA, Alomar X. Noncontrast magnetic resonance imaging for preoperative perforator mapping. Clin Plast Surg (2011) 38(2):253–61. 10.1016/j.cps.2011.03.004 [PubMed] [CrossRef] [Google Scholar]
67. Wei FC, Al Deek NF, Lin Tay SK. Principles and Techniques of Microvascular Surgery Neligan PC, Gurtner GC, editors. , Plastic Surgery. Vol. 1: Principles 4th ed Canada: Elsevier Health Sciences; (2018). p. 444–72. [Google Scholar]
68. Yoshimatsu H, Yamamoto T, Iwamoto T, Hayashi A, Narushima M, Iida T, et al. The role of non-enhanced angiography in toe tip transfer with small diameter pedicle. Microsurgery (2015) 35(5):364–9. 10.1002/micr.22353 [PubMed] [CrossRef] [Google Scholar]
69. Song D, Pafitanis G, Yang P, Narushima M, Li Z, Liu L, et al. Innervated dorsoradial perforator free flap: a reliable supermicrosurgery fingertip reconstruction technique. J Plast Reconstr Aesthet Surg (2017) 70(8):1001–8. 10.1016/j.bjps.2017.05.038 [PubMed] [CrossRef] [Google Scholar]
70. Fujitsu M. Pulp flap replantation of the amputated fingertip. Plast Reconstr Surg (2011) 127(3):77e–8. 10.1097/PRS.0b013e3182063451 [PubMed] [CrossRef] [Google Scholar]
71. Dagum AB. Fingertip Amputations: Supermicrosurgery and Replantation Rozmaryn LM, editor. , editor Fingertip Injuries: Diagnosis, Management and Reconstruction. New York, NY: Springer International Publishing; (2015). p. p. 83–95. [Google Scholar]
72. Hattori Y, Doi K, Ikeda K, Estrella EP. A retrospective study of functional outcomes after successful replantation versus amputation closure for single fingertip amputations. J Hand Surg Am (2006) 31(5):811–8. 10.1016/j.jhsa.2006.02.020 [PubMed] [CrossRef] [Google Scholar]
73. Regmi S, Gu JX, Zhang NC, Liu HJ. A systematic review of outcomes and complications of primary fingertip reconstruction using reverse-flow homodigital Island flaps. Aesthetic Plast Surg (2016) 40(2):277–83. 10.1007/s00266-016-0624-y [PubMed] [CrossRef] [Google Scholar]
74. Song D, Deng X, Chen Y, Xie S, Zhou X. Thinned chimeric radial collateral artery perforator flap in complex distal thumb reconstruction. Arch Orthop Trauma Surg (2015) 135(11):1623–31. 10.1007/s00402-015-2324-5 [PubMed] [CrossRef] [Google Scholar]
75. Rodriguez-Vegas M. Medialis pedis flap in the reconstruction of palmar skin defects of the digits: clarifying the anatomy of the medial plantar artery. Ann Plast Surg (2014) 72(5):542–52. 10.1097/SAP.0b013e318268a901 [PubMed] [CrossRef] [Google Scholar]
76. Iwuagwu FC, Orkar SK, Siddiqui A. Reconstruction of volar skin and soft tissue defects of the digits including the pulp: experience with the free SUPBRA flap. J Plast Reconstr Aesthet Surg (2015) 68(1):26–34. 10.1016/j.bjps.2014.08.064 [PubMed] [CrossRef] [Google Scholar]
77. Kim S, Jeong H, Choi TH, Kim JS. Successful re-plantation of an amputated nasal segment by supermicrosurgery: a case report and review of the literature. J Plast Reconstr Aesthet Surg (2010) 63(4):e380–83. 10.1016/j.bjps.2009.10.012 [PubMed] [CrossRef] [Google Scholar]
78. Stupka I, Dvorak Z, Vesely J, Novak P, Perrotta RE, Lombardo GA. Reconstruction of a nose bitten and eaten by a dog: a ten-year follow-up of a bitten-off nose replantation performed on an eleven-year-old boy. Ann Plast Surg (2015) 75(6):585–7. 10.1097/SAP.0000000000000643 [PubMed] [CrossRef] [Google Scholar]
79. Koshima I, Urushibara K, Okuyama H, Moriguchi T. Ear helix flap for reconstruction of total loss of the upper eyelid. Br J Plast Surg (1999) 52(4):314–6. 10.1054/bjps.1998.3055 [PubMed] [CrossRef] [Google Scholar]
80. Bayramiçli M, Akdeniz ZD. Urethra reconstruction with lateral pectoral flap in female-to-male transsexual patients. J Plast Reconstr Aesthet Surg (2016) 69(11):1558–60. 10.1016/j.bjps.2016.05.030 [PubMed] [CrossRef] [Google Scholar]
81. Koshima I, Inagawa K, Okuyama N, Moriguchi T. Free vascularized appendix transfer for reconstruction of penile urethras with severe fibrosis. Plast Reconstr Surg (1999) 103(3):964–9. 10.1097/00006534-199903000-00030 [PubMed] [CrossRef] [Google Scholar]
82. Koshima I, Inagawa K, Yamamoto M, Moriguchi T. New microsurgical breast reconstruction using free paraumbilical perforator adiposal flaps. Plast Reconstr Surg (2000) 106(1):61–5. 10.1097/00006534-200007000-00011 [PubMed] [CrossRef] [Google Scholar]
83. Koshima I, Narushima M, Mihara M, Uchida G, Nakagawa M. Fascicular turnover flap for nerve gaps. J Plast Reconstr Aesthet Surg (2010) 63(6):1008–14. 10.1016/j.bjps.2009.02.083 [PubMed] [CrossRef] [Google Scholar]
84. Geuna S, Papalia I, Ronchi G, D'Alcontres FS, Natsis K, Papadopulos NA, et al. The reasons for end-to-side coaptation: how does lateral axon sprouting work? Neural Regen Res (2017) 12(4):529–33. 10.4103/1673-5374.205081 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
85. Ito T, Nakagawa R, Ishiura R, Yamamoto T, Narushima M. Nerve reconstruction after sural nerve biopsy with supermicrosurgical fascicular turnover flap. J Plast Reconstr Aesthet Surg (2016) 69(1):146 10.1016/j.bjps.2015.08.005 [PubMed] [CrossRef] [Google Scholar]
86. Chen WF, Eid A, Yamamoto T, Keith J, Nimmons GL, Lawrence WT. A novel supermicrosurgery training model: the chicken thigh. J Plast Reconstr Aesthet Surg (2014) 67(7):973–8. 10.1016/j.bjps.2014.03.024 [PubMed] [CrossRef] [Google Scholar]
87. Gallagher AG, Ritter EM, Champion H, Higgins G, Fried MP, Moses G, et al. Virtual reality simulation for the operating room. Ann Surg (2005) 241(2):364–72. 10.1097/01.sla.0000151982.85062.80 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
88. Matsumura N, Horie Y, Shibata T, Kubo M, Hayashi N, Endo S. Basic training model for supermicrosurgery: a novel practice card model. J Reconstr Microsurg (2011) 27(6):377–82. 10.1055/s-0031-1281518 [PubMed] [CrossRef] [Google Scholar]
89. Liu HL. Microvascular anastomosis of submillimeter vessels-a training model in rats. J Hand Microsurg (2013) 5(1):14–17. 10.1007/s12593-013-0089-z [PMC free article] [PubMed] [CrossRef] [Google Scholar]
90. Yamashita S, Sugiyama N, Hasegawa K, Namba Y, Kimata Y. A novel model for supermicrosurgery training: the superficial inferior epigastric artery flap in rats. J Reconstr Microsurg (2008) 24(8):537–43. 10.1055/s-0028-1088226 [PubMed] [CrossRef] [Google Scholar]
91. Sakrak T, Köse AA, Karabağli Y, Koçman AE, Ozbayoğlu AC, Cetįn C. Rat tail revascularization model for advanced microsurgery training and research. J Reconstr Microsurg (2011) 27(7):391–6. 10.1055/s-0031-1281519 [PubMed] [CrossRef] [Google Scholar]
92. Sucher R, Lin CH, Zanoun R, Atsina KK, Weinstock M, Pulikkotil B, et al. Mouse hind limb transplantation: a new composite tissue allotransplantation model using nonsuture supermicrosurgery. Transplantation (2010) 90(12):1374–80. 10.1097/TP.0b013e3181ff4fc3 [PubMed] [CrossRef] [Google Scholar]
93. Maire N, Naito K, Lequint T, Facca S, Berner S, Liverneaux P. Robot-assisted free toe pulp transfer: feasibility study. J Reconstr Microsurg (2012) 28(7):481–4. 10.1055/s-0032-1313760 [PubMed] [CrossRef] [Google Scholar]
94. Kisu I, Mihara M, Banno K, Hara H, Yamamoto T, Araki J, et al. A new surgical technique of uterine auto-transplantation in cynomolgus monkey: preliminary report about two cases. Arch Gynecol Obstet (2012) 285(1):129–37. 10.1007/s00404-011-1901-2 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
95. So KF, Kf S. The optic nerve transplantation and whole eyeball transplantation in the zebrafish. Invest Ophthalmol Vis Sci (2016) 57(4):2139 10.1167/iovs.16-19107 [PubMed] [CrossRef] [Google Scholar]
96. Jin S, He Y, Tian Z, Feng S, Zhang Y. Superficial circumflex iliac artery perforator flap aided by color Doppler sonography mapping for like-with-like buccal reconstruction. Oral Surg Oral Med Oral Pathol Oral Radiol (2015) 119(2):170–6. 10.1016/j.oooo.2014.10.024 [PubMed] [CrossRef] [Google Scholar]
97. Ono S, Sebastin SJ, Ohi H, Chung KC. Microsurgical flaps in repair and reconstruction of the hand. Hand Clin (2017) 33(3):425–41. 10.1016/j.hcl.2017.04.001 [PubMed] [CrossRef] [Google Scholar]
98. Angrigiani C, Rancati A, Artero G, Khouri RK, Walocko FM. Stacked thoracodorsal artery perforator flaps for unilateral breast reconstruction. Plast Reconstr Surg (2016) 138(6):969e–72. 10.1097/PRS.0000000000002740 [PubMed] [CrossRef] [Google Scholar]
99. Stalder MW, Lam J, Allen RJ, Sadeghi A. Using the retrograde internal mammary system for stacked perforator flap breast reconstruction: 71 breast reconstructions in 53 consecutive patients. Plast Reconstr Surg (2016) 137(2):265e 10.1097/01.prs.0000475743.08559.b6 [PubMed] [CrossRef] [Google Scholar]
100. Rosson GD, Holton LH, Silverman RP, Singh NK, Nahabedian MY. Internal mammary perforators: a cadaver study. J Reconstr Microsurg (2005) 21(4):239–42. 10.1055/s-2005-871750 [PubMed] [CrossRef] [Google Scholar]
101. Patel NG, Rozen WM, Chow WT, Chowdhry M, Fitzgerald O'Connor E, Sharma H, et al. Stacked and bipedicled abdominal free flaps for breast reconstruction: considerations for shaping. Gland Surg (2016) 5(2):115–21. 10.3978/j.issn.2227-684X.2016.02.03 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
102. Dellacroce FJ, Sullivan SK, Trahan C. Stacked deep inferior epigastric perforator flap breast reconstruction: a review of 110 flaps in 55 cases over 3 years. Plast Reconstr Surg (2011) 127(3):1093–9. 10.1097/PRS.0b013e318205f223 [PubMed] [CrossRef] [Google Scholar]
103. Hallock GG. The chimera flap: a quarter century odyssey. Ann Plast Surg (2017) 78(2):223–9. 10.1097/SAP.0000000000000884 [PubMed] [CrossRef] [Google Scholar]
104. Yamamoto T, Saito T, Ishiura R, Iida T. Quadruple-component superficial circumflex iliac artery perforator (SCIP) flap: A chimeric SCIP flap for complex ankle reconstruction of an exposed artificial joint after total ankle arthroplasty. J Plast Reconstr Aesthet Surg (2016) 69(9):1260–5. 10.1016/j.bjps.2016.06.010 [PubMed] [CrossRef] [Google Scholar]
105. Fernandez Garrido M, Qiu SS, Vega Garcia C, Pons Playa G, Masiá Ayala J. Chimeric Superficial Circumflex Iliac Perforator Flap Including External Oblique Fascia: A Refinement of Conventional Harvesting. Plast Reconstr Surg Glob Open (2016) 4(6):e766 10.1097/GOX.0000000000000757 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
106. Fitzgerald O'Connor EJ, Vesely M, Holt PJ, Jones KG, Thompson MM, Hinchliffe RJ. A systematic review of free tissue transfer in the management of non-traumatic lower extremity wounds in patients with diabetes. Eur J Vasc Endovasc Surg (2011) 41(3):391–9. 10.1016/j.ejvs.2010.11.013 [PubMed] [CrossRef] [Google Scholar] |


