马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
背景
增强解剖结构可视化的成像技术可以帮助预防胆管损伤。近红外荧光成像就是这样一种技术。以前的ICG实验表明,肝外胆管的照射是可行的。然而,与背景相比,目标的可视化存在改进的空间。 IRDye®800CW的实验显示出有希望的结果。然而,这种染料对于常规临床使用来说太昂贵了。本研究的目的是测试两种新开发的临床前染料对于胆囊管和胆囊动脉的术中成像的首次适用性,与IRDye®800CW相比较。
方法
使用腹腔镜荧光成像系统在三只猪中进行腹腔镜胆囊切除术。每只猪通过静脉注射接受6mg荧光染料之一(1mg / mL;IRDye®800CW,IRDye®800BK或IRDye®800NOS)。在设定的时间点记录术中识别胆道系统和胆囊动脉。数字记录所有程序,并确定目标与背景比(TBR)以评估荧光信号。
结果
使用所有三种荧光染料,直接观察到胆囊动脉。对于胆囊管的可视化,分别使用IRDye®800BK,IRDye®800NOS和IRDye®800CW需要15,34和30分钟。 36分钟后,IRDye®800NOS(4.20)的胆囊管最大TBR最高,而IRDye®800BK为2.45,IRDye®800CW为2.15,均为45分钟。没有不良事件。
结论
IRDye®800BK和IRDye®800NOS似乎是IRDye®800CW的良好替代品,可用于猪的胆囊管和胆囊动脉的可视化。
关键词:荧光染料,近红外荧光成像,胆道解剖,腹腔镜胆囊切除术,荧光胆管造影
腹腔镜胆囊切除术是症状性胆囊结石或急性胆囊炎的标准治疗,是西半球最常用的外科手术之一。据报道,腹腔镜手术中胆管损伤的发生率为0.4-1.4%[1,2]。这种损伤与发病率增加,生存率降低,生活质量受损有关,并对社会产生经济后果[2,3]。胆管或血管系统的解剖变异并不罕见,并且代表了手术并发症和手术并发症的来源[3,4]。因此,需要增强胆道解剖结构的术中可视化以减少胆管损伤的发生率。
近红外荧光(NIRF)成像是用于围手术期解剖结构的实时描绘的有前景的技术。在其他应用中,它用于腹腔镜胆囊切除术中肝外胆管和胆囊动脉的可视化,以及结直肠,泌尿外科和妇科手术中输尿管的可视化[5-7]。在临床环境中,ICG是用于胆管成像的染料,具有合理的可视化结果,使临床使用成为可能。可以识别肝外胆管和胆囊动脉[8]。然而,主观上,靶标的成像在所有患者中都不是最佳的。目标和背景之间更好的对比度预计会增加该技术的实用性。设备的适应性及其特性是解决这一问题的一种方法。染料或其使用的改变是另一种。一种这样的改变是建议在手术前一天注射染料[9]。然而,由于通常进行当天入院,从物流的角度来看这是不可取的。应用另一种荧光染料是另一种可能性。
IRDye®800CW(LICOR Biotechnology,Lincoln,United States)是一种实验染料,与腹腔镜成像相结合,可以在术中观察关键的解剖结构。在作者小组进行的先前动物实验中,将该染料与ICG进行比较,用于肝脏外胆管和胆囊动脉的成像。主要结果是早期可见的胆囊管,使用IRDye®CW-800和较高的囊 - 动脉靶 - 背比[10]。这与其他两项研究一致,使这种新染料有望用于未来的临床应用[10-12]。然而,IRDye®CW-800的一个主要缺点是其成本,几乎是ICG的十倍。因此,需要更实惠的替代品。
最近,IRDye®800CW的制造商开发了两种新的临床前染料,IRDye®800BK和IRDye®800NOS,其生产成本可与市售的ICG相媲美。通常,这三种染料具有相似的性质。发射和吸收与ICG的波长大致相同。染料的亲水性不同,IRDye®800NOS亲水性最差。这会影响它们的排泄和它们在肝脏中的摄取,并且可能使它们在胆囊管的成像能力方面更有效。本研究的目的是使用市售的腹腔镜荧光成像系统评估这些染料与IRDye®800CW相比,用于NIRF腹腔镜检查肝外胆管和猪胆囊动脉的性能。
材料和方法
该研究在马斯特里赫特大学(荷兰马斯特里赫特)的中心动物设施进行。动物的使用符合荷兰动物研究立法的规定,并遵循当地动物伦理委员会批准的方案。选择猪模型是因为它与人类肝胆解剖结构的相似性,并且因为以前成功的实验已经在猪中进行了NIRF成像[10]。三只雌性荷兰长白猪,体重40公斤,用于本研究。手术后,由麻醉师处死猪。
腹腔镜荧光成像系统
使用市售的腹腔镜荧光成像系统(Karl Storz GmbH&CO.KG,Tuttlingen,Germany)。 NIR光源D-Light P是基于氙的系统,为近红外波长范围内的荧光应用提供照明光。它能够激发所有呈现的染料:IRDye 800CW(ʎEX/ EM = 775 / 796nm),IRDye 800BK(ʎEX/ EM = 774 / 790nm)和IRDye 800NOS(ʎEX/ EM = 767 / 786nm)。脚踏板允许外科医生在两种成像模式之间轻松切换。所有程序均以数字方式记录。对于所有三种染料,使用相同的NIRF成像设置。
近红外染料的特性和制备
IRDye®800CW是一种四磺化七甲基吲哚菁染料。静脉注射由肝脏迅速清除并排泄到胆汁中。它也被肾脏清除并排泄到尿液中。该染料的峰值吸收为775nm,峰值激发发射为796nm。分子量为1090.11Da [13,14]。
IRDye®800BK(LICOR Biotechnology,Lincoln,United States)是一种新开发的染料,主要用于输尿管的术中可视化。该亲水性染料的最大吸收为774nm,最大发射为790nm。由于其亲水性,它主要由肾脏清除。尽管如此,在结构上与IRDye®800CW相似,可以预期肝脏可以进行一些额外的清除。
IRDye®800NOS(LICOR Biotechnology,Lincoln,United States)也是一种新开发的染料,亲水性较差,主要用于胆道系统的术中可视化。该染料主要由肝脏清除,最大吸收为767nm,最大发射为786nm。
按照制造商的说明制备所有三种染料。将它们在无菌磷酸盐缓冲盐水(PBS)溶液中稀释至浓度为1毫克/毫升。制备该稀释液中的6毫克每种染料用于静脉内注射。
手术技术
术前用药包括肌内注射阿扎哌隆3mg / kg,氯胺酮10mg / kg和阿托品0.05mg / kg。静脉注射硫喷妥钠10-15mg / kg诱导麻醉。插管后,将猪用异氟烷和氧气保持麻醉。两名专业的内窥镜胃肠外科医生(NB和LS)进行了手术,并得到了手术经验丰富的住院医生的协助。根据荷兰指南和腹腔镜胆囊切除术的最佳实践应用临床安全技术[15,16],在每只猪中进行腹腔镜胆囊切除术。使用6mg剂量(1mg / mL)对每只动物测试一种染料。这是早期研究证明的足够剂量的两倍[10]。选择剂量以获得最大可视化,因为作者的假设是较高剂量的染料将导致更好的胆道成像。在染料注射后立即开始荧光成像,随后在荧光模式和白光模式下间歇地进行成像。在手术中,研究人员在任何一种成像模式中系统地记录了是否可以识别胆囊管或胆囊动脉的形式。为了就上述结构的识别达成协议,咨询了主治医生。如果经验丰富的外科医生非常确定地确定了其定位,则将结构评分为“已识别”。
术后定量荧光分析
使用OSIRIX v7.0.1成像软件(Pixmeo,Geneva,Switzerland)评估程序的视频记录的荧光照射程度。使用该软件,可以确定目标 - 背景比(TBR)。 TBR定义为目标(胆囊动脉或胆囊管)中三个目标点的平均荧光强度(任意单位FI,AU),减去背景中三个目标点的平均荧光强度(肝门) ,除以背景中三个感兴趣点的平均荧光强度。在公式中:TBR =(目标的FI - 背景的FI)/(FI背景)[8,10]。在这些感兴趣的点上避免了具有光散射的区域。
结果
在所有实验中,成功进行了用NIRF成像鉴定胆囊管和胆囊动脉。手术中获得的结果见表1中的术中登记表。
表格1
术中登记表

在第一头猪(IRDye®800BK)中,注射荧光染料后直接清晰显示胆囊动脉。 15分钟后,胆囊管显示出NIRF信号。第二只猪(IRDye®800NOS)在注射染料后立即显示出胆囊动脉。然而,由于该过程早期的技术问题,未记录该可视化,因此不能从该荧光胆囊动脉获得TBR。 34分钟后,胆囊管清晰可见。然而,胆囊的操作被证明对胆囊管的可视化有影响。脆弱管道的拉伸太多会阻止荧光染料的流入。这在34分钟后得到纠正。与前两头猪一样,在接受IRDye®800CW染料的第三头猪中也清晰可见胆囊动脉。 30分钟后,可以以荧光模式鉴定胆囊管。
在所有三只猪中,除了胆囊管和胆囊动脉外,其他结构变得可见。双眼子宫主观上是所有三头猪腹部中发荧光最多的子宫。此外,在所有三只猪的荧光模式中都可以看到输尿管,小肠和淋巴结。
目标与背景比率
术后,通过测量目标 - 背景比(TBR)来分析视频记录。 IRDye®800BK和IRDye®800CW的胆囊动脉TBR分别为6.78和7.54。由于操作早期的视频记录程序存在技术问题,因此无法测量IRDye®800NOS的胆囊动脉TBR。对于IRDye®800BK,IRDye®800NOS和IRDye®800CW,来自三种染料的胆囊管的最大测量TBR分别为2.45(45分钟),4.20(35分钟)和2.15(45分钟)。图1-3显示了在这些最大测量TBR期间的囊性导管。所有图像均在Image1 SPIES系统的相同荧光设置下制作。然而,从图像中可以看出,使用IRDye®800NOS,腹腔镜离胆囊管更远。每种染料具有最大TBR的图像显示在图1,图22和图33中。

图1
在注射6mgIRDye®800BK(1 mg / mL)后,观察胆囊管45分钟(最大信号的时间点)。 注意,小白点是由散射引起的,并不代表荧光信号
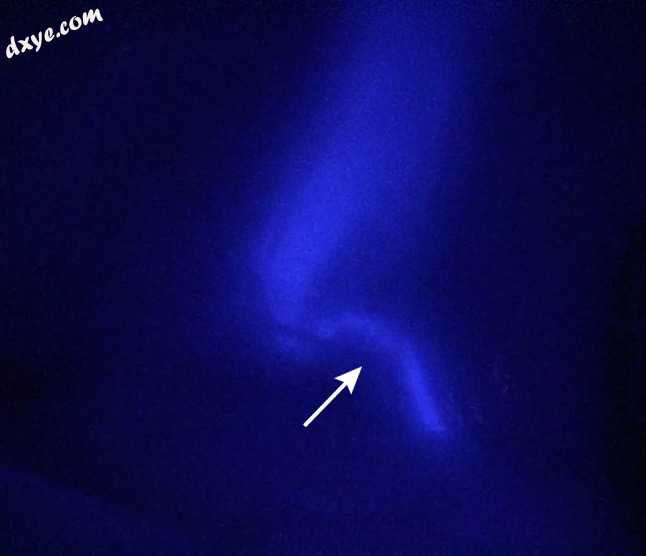
图2
注射6mgIRDye®800NOS(1 mg / mL)后胆囊管(箭头所示)和胆囊底部35 min(最大信号时间点)的可视化

图3
在注射6mg的IRDye®800CW(1mg / mL)后,可视化胆囊管(箭头所示)和胆总管,45分钟(最大信号的时间点)。注意白点是由散射引起的,并不代表荧光信号
安全
在手术过程中,没有一只猪出现并发症或不良反应,这可归因于其中一种染料。特别是,没有观察到心率和呼吸状态的血压的改变。在注射荧光染料后的第一分钟内,仅观察到外周氧饱和度(SpO2)的术中监测的轻微和短暂的减少。
讨论
在本研究中,研究了使用两种新的临床前染料用于肝外胆管的NIRF成像和市售的腹腔镜成像系统。这种新染料类似于先前有利的IRDye®800CW的结构和光谱特性,但成本低得多,现在属于市售的ICG。这两个特征对于未来可能的临床应用至关重要该实验的目的是首先评估新染料的NIRF特性,并将其与IRDye®800CW的性能进行比较。最终,这些染料可以替代ICG,ICG是目前唯一可用于胆道系统NIRF成像的染料。这与ICG一样是理想的,尽管可以实现胆管的NIRF可视化,但目标 - 背景的观察对比度仍有改进的空间。其他优点是染料注入和目标结构可视化之间的时间较短,以及这些新染料不含碘的事实,而一些商业上可获得的ICG制剂[17]。因此,这些新染料也适用于已知具有碘过敏或过敏的患者。最终的好处是,这些染料不仅可以通过肝脏清除,还可以通过肾脏清除,这一点从IRDye®800CW中已知。这可以使这些染料适合于输尿管成像。
所有三种染料在静脉注射后直接显示出胆囊动脉的清晰可见性。在15至35分钟之间,使用所有三种染料,实现了胆囊管的清晰可视化。 IRDye®800BK和IRDye®800NOS均比早期测试的IRDye®800CW产生更突出的荧光信号。在本研究中发现IRDye®800CW的TBR为2.15,与TBR为2.3的早期研究相当[10]。来自IRDye®800NOS的信号强于IRDye®800BK的信号。这是预期的,因为IRDye®800NOS的亲水性较低,并且应该比IRDye®800BK更通过胆汁排泄。在之前的一项研究中,ICG和IRDye®CW800的TBR具有可比性[10]。目前的结果表明IRDye®800NOS可能对胆管成像更有效。这对应于外科医生的主观印象。当然,这些数据必须谨慎解释并需要确认。本研究中TBR测量的一个可能的限制是腹腔镜和胆囊管在不同时间点之间的距离不均匀。如图1-3所示,使用IRDye®800NOS的猪的距离更大。感兴趣区域与腹腔镜之间的较大距离可能导致较低的荧光强度[18]。然而,IRDye®800NOS的TBR是所有发现的TBR中最高的。
由于染料的给药,没有不良反应。测量了氧饱和度的非常早期和短暂的降低;这是使用静脉内荧光染料的常见现象[19-21]。血液颜色的瞬时变化导致氧气测量结果错误地低于实际值。
在实验过程中,观察到三种染料都被肝脏(和排泄到胆汁中)和肾脏(并排泄到尿液中)清除。因此,所有三种染料都可能适用于胆道解剖结构和输尿管的成像,但如前所述,IRDye®800NOS更多地排泄在胆汁中,而尿液中的IRDye®800BK更多。在该实验中,通过IRDye®800NOS的胆管中较高的TBR证实了这一点。这些染料的确切行为需要进一步研究胆道和尿液成像。由于尿液中染料量的不确定性,给定剂量设定为先前使用IRDye®800CW成功进行胆管成像的实验的两倍[10]。本研究中IRDye®800CW的TBR与之前的观察结果相当,可能表明使用IRDye®800CW时双剂量无影响。在本研究中,与Schols等人的研究报告相比,IRDye®800CW需要更长时间才能看到。 2014年,胆囊管在11分钟后可区分[10]。 Tanaka等人。 2014年大约20分钟后在胆囊管中测量荧光,这与目前的结果相当[11]。使用的不同剂量可能对荧光出现之前的时间产生影响。也不能排除另一剂量而不是所选剂量给出优异的成像。需要进一步的实验来确定受染料的药代动力学性质影响的最佳剂量和时间。
该研究还有两个局限。首先,由于实验系列有限,必须谨慎解释结果。由于仅使用了三头猪,每种染料仅在一头猪中进行测试。这导致在第二只猪的早期开始录像的失败,其中IRDye®800NOS被测试,在随后的实验中无法纠正。因此,在该猪中不可能用TBR测量胆囊动脉的可视化。另一个限制是作者观察到胆囊和胆囊管的操作对胆汁中的荧光染料通过第二头猪的胆囊管的流动的影响。不能排除通过适应操作可以获得早期成像。这可能影响了其他猪的胆汁流量和详细的时间测量。该程序的缺点是必须在胆道系统的NIRF和白光成像之间间歇地切换。这是所用设备所固有的。虽然同时白光和荧光成像可能更实用,但外科医生并未将此视为阻碍,并且可以在足够数量的时间点执行测量以执行相关观察。
本研究主要关注新染料的评估,以优化NIRF成像。改善NIRF成像的另一种方法是改进设备及其性能。这种方法也很重要,但超出了本实验的范围。
结论
本研究显示了两种新的且价格合理的NIRF成像染料的有希望的结果:IRDye®800BK和IRDye®800NOS,用于胆囊管和胆囊动脉的近红外荧光成像。目前,这些染料尚未获得FDA批准,IRDye®800CW的情况仍然如此,因此尚不适用于人体临床实践。新型染料似乎是IRDye®800CW在猪胆囊管和胆囊动脉可视化中的良好替代品。为了成为目前唯一可供人类使用的染料的替代品,ICG需要进一步研究和FDA批准。
参考:
Near-infrared fluorescence laparoscopy of the cystic duct and cystic artery: first experience with two new preclinical dyes in a pig model
1. Vollmer CM, Jr, Callery MP. Biliary injury following laparoscopic cholecystectomy: why still a problem? Gastroenterology. 2007;133(3):1039–1041. doi: 10.1053/j.gastro.2007.07.041. [PubMed] [CrossRef] [Google Scholar]
2. Huang Q, Yao HH, Shao F, Wang C, Hu YG, Hu S, et al. Analysis of risk factors for postoperative complication of repair of bile duct injury after laparoscopic cholecystectomy. Dig Dis Sci. 2014;59(12):3085–3091. doi: 10.1007/s10620-014-3255-7. [PubMed] [CrossRef] [Google Scholar]
3. Viste A, Horn A, Ovrebo K, Christensen B, Angelsen JH, Hoem D. Bile duct injuries following laparoscopic cholecystectomy. Scand J Surg. 2015;104(4):233–237. doi: 10.1177/1457496915570088. [PubMed] [CrossRef] [Google Scholar]
4. Way LW, Stewart L, Gantert W, Liu K, Lee CM, Whang K, et al. Causes and prevention of laparoscopic bile duct injuries: analysis of 252 cases from a human factors and cognitive psychology perspective. Ann Surg. 2003;237(4):460–469. [PMC free article] [PubMed] [Google Scholar]
5. Schols RM, Connell NJ, Stassen LP. Near-infrared fluorescence imaging for real-time intraoperative anatomical guidance in minimally invasive surgery: a systematic review of the literature. World J Surg. 2015;39(5):1069–1079. doi: 10.1007/s00268-014-2911-6. [PubMed] [CrossRef] [Google Scholar]
6. Handgraaf HJ, Verbeek FP, Tummers QR, Boogerd LS, van de Velde CJ, Vahrmeijer AL, et al. Real-time near-infrared fluorescence guided surgery in gynecologic oncology: a review of the current state of the art. Gynecol Oncol. 2014;135(3):606–613. doi: 10.1016/j.ygyno.2014.08.005. [PubMed] [CrossRef] [Google Scholar]
7. Autorino R, Zargar H, White WM, Novara G, Annino F, Perdona S, et al. Current applications of near-infrared fluorescence imaging in robotic urologic surgery: a systematic review and critical analysis of the literature. Urology. 2014;84(4):751–759. doi: 10.1016/j.urology.2014.05.059. [PubMed] [CrossRef] [Google Scholar]
8. Schols RM, Bouvy ND, van Dam RM, Masclee AA, Dejong CH, Stassen LP. Combined vascular and biliary fluorescence imaging in laparoscopic cholecystectomy. Surg Endosc. 2013;27(12):4511–4517. doi: 10.1007/s00464-013-3100-7. [PubMed] [CrossRef] [Google Scholar]
9. Verbeek FP, Schaafsma BE, Tummers QR, van der Vorst JR, van der Made WJ, Baeten CI, et al. Optimization of near-infrared fluorescence cholangiography for open and laparoscopic surgery. Surg Endosc. 2014;28(4):1076–1082. doi: 10.1007/s00464-013-3305-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
10. Schols RM, Lodewick TM, Bouvy ND, van Dam DA, Meijerink WJ, van Dam GM, et al. Near-infrared fluorescence laparoscopy of the cystic duct and artery in pigs: performance of a preclinical dye. J Laparoendosc Adv Surg Tech Part A. 2014;24(5):318–322. doi: 10.1089/lap.2013.0590. [PubMed] [CrossRef] [Google Scholar]
11. Tanaka E, Choi HS, Humblet V, Ohnishi S, Laurence RG, Frangioni JV. Real-time intraoperative assessment of the extrahepatic bile ducts in rats and pigs using invisible near-infrared fluorescent light. Surgery. 2008;144(1):39–48. doi: 10.1016/j.surg.2008.03.017. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
12. Korb ML, Huh WK, Boone JD, Warram JM, Chung TK, de Boer E, et al. Laparoscopic fluorescent visualization of the ureter with intravenous IRDye800CW. J Minim Invasive Gynecol. 2015;22(5):799–806. doi: 10.1016/j.jmig.2015.03.008. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
13. Leung K (2004) IRDye 800CW-human serum albumin. Molecular imaging and contrast agent database (MICAD). Bethesda (MD).
14. Biosciences L-C. IRDye® 800CW dye structures (2016). https://www.licor.com/bio/produc ... 0cw/structure.html.
15. Lange JF SL (2006) Best practice: De techniek van de laparoscopische cholecystectomie (Critical View of Safety [CVS]; Werkgroep Endoscopische Chirurgie van de Nederlandse Vereniging voor Heelkunde). http://www.nvgic.nl/richtlijnen/ ... olecystectomie.pdf.
16. Strasberg SM, Hertl M, Soper NJ. An analysis of the problem of biliary injury during laparoscopic cholecystectomy. J Am Coll Surg. 1995;180(1):101–125. [PubMed] [Google Scholar]
17. Penha FM, Rodrigues EB, Maia M, Meyer CH, Costa Ede P, Dib E, et al. Biochemical analysis and decomposition products of indocyanine green in relation to solvents, dye concentrations and laser exposure. Ophthalmologica. 2013;230(Suppl 2):59–67. doi: 10.1159/000353871. [PubMed] [CrossRef] [Google Scholar]
18. Kono Y, Ishizawa T, Tani K, Harada N, Kaneko J, Saiura A, et al. Techniques of fluorescence cholangiography during laparoscopic cholecystectomy for better delineation of the bile duct anatomy. Medicine (Baltimore) 2015;94(25):e1005. doi: 10.1097/MD.0000000000001005. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
19. Scheller MS, Unger RJ, Kelner MJ. Effects of intravenously administered dyes on pulse oximetry readings. Anesthesiology. 1986;65(5):550–552. doi: 10.1097/00000542-198611000-00023. [PubMed] [CrossRef] [Google Scholar]
20. Ediriwickrema LS, Francis JH, Arslan-Carlon V, Dalecki PH, Brodie SE, Marr BP, et al. Intravenous injection of indocyanine green results in an artificial transient desaturation by pulse oximetry. Retin Cases Brief Rep. 2015;9(3):252–255. doi: 10.1097/ICB.0000000000000152. [PubMed] [CrossRef] [Google Scholar]
21. Baek HY, Lee HJ, Kim JM, Cho SY, Jeong S, Yoo KY. Effects of intravenously administered indocyanine green on near-infrared cerebral oximetry and pulse oximetry readings. Korean J Anesthesiol. 2015;68(2):122–127. doi: 10.4097/kjae.2015.68.2.122. [PMC free article] [PubMed] [CrossRef] [Google Scholar] |


