马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
背景
用于肝移植(LT)的活体供体(LD)是微创手术的最佳靶标。用于LD的腹腔镜辅助手术(LAS)已逐渐发展。应保证捐助者的安全率为100%。
方法
作者于2012年6月开始为LD进行LAS。本报告的目的是详细描述LAS的外科手术,讨论各种提示和陷阱,并解决向更高级LAS平稳过渡的可能性。
结果
基于三维图像分析的术前计划是成功手术的有力工具。肝脏收缩/反作用和气腹产生的压力的组合加宽了可分解/可切割层,增加了LAS的安全性。灵活的腹腔镜在沿着下腔静脉的水平视图中,在足够的肝脏收缩下提供极好的放大视力,并且在侧视图中,在关键程序中采集左侧移植物。故意遗漏疼痛切口对LD有益。如果使用悬挂操作,使用较小的中线切口的肝切除术是安全的。从LAS到混合技术的安全过渡,包括纯腹腔镜手术和随后的开放手术相结合似乎是可能的。
结论
LDLT外科医生拥有非常广泛的知识和技术前沿。
关键词:腹腔镜肝切除术,供体手术,供体,腹腔镜手术,腹腔镜检查
介绍
纯腹腔镜手术(PLS)已被广泛应用于各个领域。与常规开放手术(OS)相比,PLS的优点在于它具有更少的失血,更少的疼痛,更低的发病率,更早的术后摄食和更短的住院时间[1-4]。对患者的益处得到了很好的验证[1-9]。然而,特别是在肝胆胰(HBP)手术领域,由于技术困难,长期学习曲线和大量出血,PLS发展相对缓慢[1-3,9,10]。
活体肝移植(LDLT)需要健康的个体作为活体供体(LD)。围手术期损伤应尽可能减少,LDLT LD是微创手术的最佳目标[1,5,7,9,11-14],因为他或她本身不需要侵入性外科手术。此外,应保证捐助者的安全率为100%[6,7,15,16]。
每个国家都有自己的健康保险制度。日本政府采用全民医疗保险制度。因此,日本的新手术程序在被政府理事会列入健康保险制度列表之前不予批准。不幸的是,一些HBP外科医生违反了医疗道德准则,忽视了日本的医疗保险制度,他们的腹腔镜手术技术在2014年成为社会问题。然而,腹腔镜HBP手术可能具有实质性的益处[1-9]。少数无心的外科医生不应该影响先进的HBP手术的表现。应为LDLT制定针对LD的高级外科手术的具体规定和道德政策[15,16],并应在全世界传播技术发展[5,7]。
作者采用腹腔镜在LD中进行移植物采集,作者利用腹腔镜辅助手术(LAS)的概念。 LAS不被认为是一种手助腹腔镜手术(HALS),而是OS的扩展[9,10,12,13,17,18]。术前成像技术和手术装置目前都很发达[19,20],因此如果使用悬挂操作,通过小中线切口直视的肝切除术是安全的[21,22] [18,23]。因此,作者在此专注于为准备悬挂操作而执行的外科手术。作者详细描述了作者的程序,并讨论了提示和陷阱。此外,作者讨论了从LAS到PLS或混合技术(HT)平稳过渡的可能性。
患者和方法
道德批准
日本长崎大学的技术外科医生之前向作者提供了有关其LAS手术的说明[21,22,24],使作者能够开发自己的LAS技术。作者的LDLT计划中使用的LAS协议已经作者的机构审查委员会批准(批准的第991号;京都大学医学研究生院伦理审查委员会,日本京都)。因此,LD的LAS于2012年6月被引入LDLT程序。
结果
术前影像学检查
应首先进行肝残余物的体积评估,以确保LD的安全性。作者使用成像软件(HepaVision,MeVis软件; MeVisLab,Bremen,德国)对肝脏残余和移植物体积进行体积分析。精确识别门静脉(PV)和肝静脉(HV)区域也很重要。在肝脏残余和肝脏同种异体移植物中,应准确评估由PV阻塞引起的门静脉缺血预测区域和HV牺牲引起的静脉淤血[25]。
应该精确地进行解剖学分析,特别是对于LAS。在作者的机构中​​,通过高速三维(3D)图像分析系统(Synapse Vincent; Fujifilm Medical,Tokyo,Japan)[19]进行详细分析。动态计算机断层扫描检测肝动脉,PV和HV。如果需要,进行滴注输液胆管造影计算机断层扫描以分析胆管。滴注输液胆管造影计算机断层扫描比磁共振胆管造影更适合用于创建此类3D图像,尽管它与输注药物的过敏反应率较高[26]。因此,如果需要,可以在一体化包装中进行关节血管和胆管的3D成像,因为滴注输液胆管造影计算机断层扫描仅在选定的情况下进行(图1A)。

图1
(A)应在术前制作三维图像,使一体化包装中的血管(即肝静脉,门静脉和肝动脉)和胆管进行连接。 (B)从剑突下方2厘米处沿中线做出8厘米的标记。如果需要,可以从中线切口的上侧和下侧切出几个2厘米的切口(红色箭头)。为了在纯腹腔镜手术或混合技术中暴露右侧膈下区域的肝脏裸露区域,应将工作端口尽可能远地放置在头侧(红叉)。 (C)中线切口受到伤口附件的保护和缩回。 (D)单独直视可能会提供不适当的手术视野。进行足够的肝脏收缩(蓝色箭头)。 (E)视觉视力为切除镰状韧带和(F)右肝静脉周围的夹层提供了极好的手术区域。 (G)视觉视觉提供放大的视图。检测右肝静脉和中肝静脉之间的划分(绿线)并通过下腔静脉的前壁(绿色箭头)解剖。 (H)用凝胶型附件密封伤口。相机端口位于脐部,工作端口位于右侧壁(红色圆圈)。为了在纯腹腔镜手术或混合技术中暴露右侧膈下区域的肝脏裸露区域,应将工作端口尽可能远地放置在侧背侧(红十字)BAL,肝脏裸露区域; BD,胆管; HA,肝动脉; HV,肝静脉; PV,门静脉; RHV,右肝静脉
右叶移植(RLG)的采集过程
RLG采集如下进行。剑突过程得到确认。从剑突下方2厘米处开始沿中线形成8厘米的标记(图1B)。然后从中线切口的上侧和下侧开始另外的2cm标记,以确保HV和肝门的充分可视化(图1B,C).C)。使用包含GelSeal帽,Alexis伤口保护器/牵开器和无菌润滑剂的GelPort腹腔镜系统(Applied Medical Resources Co.,Rancho Santa Margarita,CA,USA)。中线切口受到伤口附件的保护和缩回(图1C)。单独的直视可能为进一步的手术提供不充分的手术区域(图1D)。然而,腹腔镜通过中线切口的组合使用是一种有效的解决方案。腹腔镜视力为切割镰状韧带提供了极好的放大场(图1E),右侧HV(RHV)周围的解剖(图1F),以及RHV和中间HV(MHV)之间的划分检测(图1)。 1G)。然后用凝胶型附件密封8cm中线切口(图1H)。在脐部放置一个5毫米的摄像头端口,在右侧壁上放置一个5毫米的工作端口(图1H)。在放置端口期间用手保护腹腔内器官(图2A)。外科医生的左手主要收缩肝脏,在有两名助手(腹腔镜辅助手术和手术助手)的情况下,通过密封口插入腹部(图2B)。如果助理外科医生熟练,则通过密封端口插入他或她的右手以缩回肝脏,并且仅通过左手操纵柔性腹腔镜。如果只有一名助手,他或她协助手术和腹腔镜检查。外科医生的右手保持与腹腔镜的紧密接触,尽管需要助手的先进技术(图2C)。在肝脏收缩下,通过钩形电极(HSE)切割右肝三角韧带(图2D)。 HSE具有同时切割和拉动组织的优点,在切割组织前方形成安全区域。因此,一个工作端口通常就足够了(图1H)。用手指进行精致且细节化的缩回/反作用,并用手进行一般和粗略的缩回/反作用(图2E)。右手肝三角韧带,右肾上腺(RAG)和下腔静脉(IVC)周围的腹膜后切口在手指和HSE的反作用下切割(图2F,G).G)。气腹产生的压力还通过二氧化碳气体的明显渗透产生可分散和可切割的层。裸露的肝脏区域暴露,RAG显示为具有其自身薄表面膜的胶囊(图2H,3A).3A)。通过手或手指辅助并在气腹压力下(图3A),通过适当的收缩/反作用产生可分离/可切割的层。该宽层尽可能靠近肝脏侧切割(图3A,B).B)。即使稍微不小心的收缩/反作用也可能容易导致RAG周围出血和/或渗出(图3C,D).D)。在肝脏收缩期间,来自para-IVC(不是来自Morrison's囊袋)的水平腹腔镜视图提供了沿着IVC的极佳视图(图3E)。暴露IVC的侧壁,然后将短的HV和肝腔韧带镂空(图3F)。如上所述,即使稍微不小心的收缩/反作用也容易导致IVC周围出血和/或渗出(图3F)。采用柔性腹腔镜的多角度视图,肝脏从膈肌中移除而不会受伤(图3G,H).H)。由气腹引起的肝脏同时收缩/反作用和压力有助于形成足够宽的可解剖/可切割层以便解剖;因此,应该尽可能有意地追踪该层尽可能靠近肝脏(图4A,B).B)。甚至手指的钝性解剖效果也很好(图4A,B).B)。在RHV根部附近仔细检测RHV和IVC的壁(图4C)。然后移除伤口密封附件。具有局部照明的直视也为RHV骨架化提供了优选的手术区域(图4D-F)F)如果进行2cm的上拉伸切口(图1B,C).C)。右侧和中侧的RHV周围的切口通过腹腔镜视觉连接(直视在右侧膈下仅提供有限的视图)(图4G)[18]。将RHV骨架化(图4H),然后用Penrose引流管悬挂(图5A)。如果看起来肝门的后续手术可能很困难,则在下侧添加伸展切口(图1B,CC)。
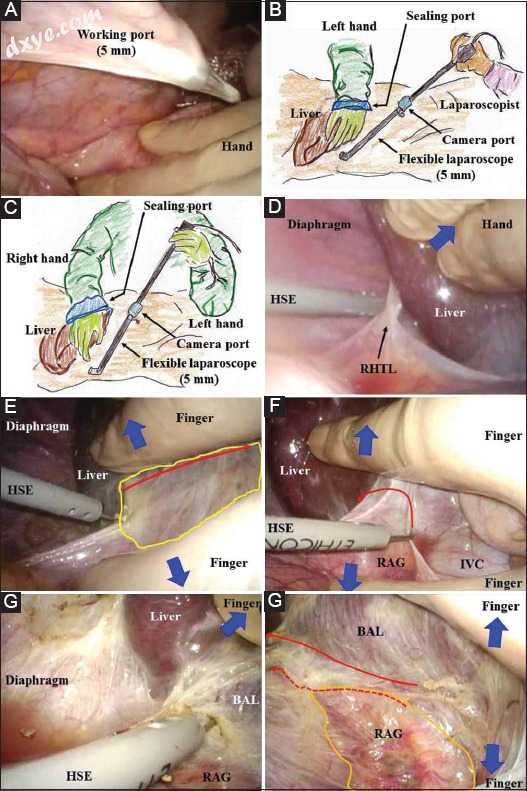
图2
(A)在放置端口时,应由外科医生的手保护腹腔内器官。 (B)在手术和腹腔镜助手都存在的情况下,左手通过密封口插入腹部。 (C)如果助理外科医生受过良好教育并且经验丰富,则通过密封端口插入他或她的右手以收回肝脏,然后仅通过左手操纵柔性腹腔镜。因此将获得具有放大视图的更协调的手术区域。 (D)右肝三角韧带在肝脏收缩时由钩形电极切割(蓝色箭头)。为了暴露右侧膈下区域的肝脏裸露区域,将工作端口尽可能远地放置在侧背侧。 (E)用手指进行精致且细节化的缩回/反作用,并用手(蓝色箭头)进行一般和粗略的缩回/反作用。气腹的压力有助于通过显著渗透二氧化碳气体(黄色区域)来形成可分解/可切割的层。腹膜后有意切除腹膜后(红色箭头)。 (F)右侧肾上腺和下腔静脉周围的腹膜后切口在靠近肝脏(红色箭头)的下方(蓝色箭头)和由钩形电极产生的张力下切割。 (G)裸露的肝脏区域暴露在外。 (H)腹膜后切口靠近肝脏(实线箭头),而不是靠近右肾上腺(虚线箭头)。应使用膜囊(橙色区域)BAL,肝脏裸露区域小心保存右侧肾上腺; HSE,钩形电极; IVC,下腔静脉; RAG,右肾上腺; RHTL,右肝三角韧带
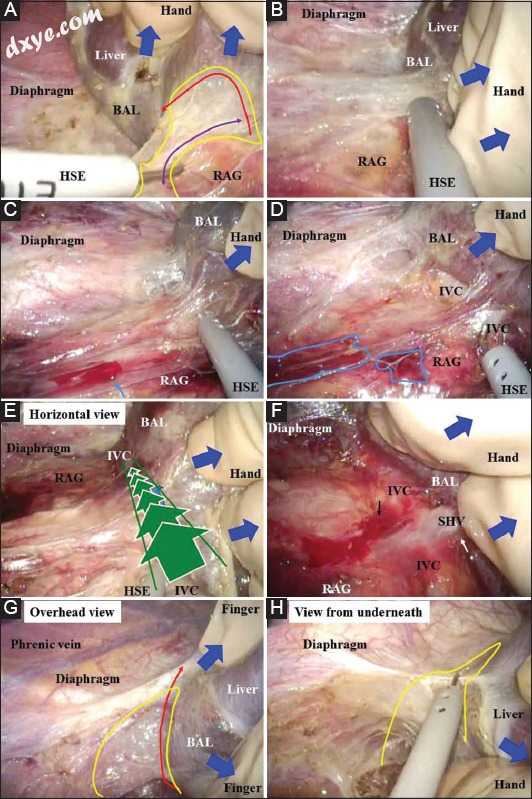
图3
(A,B)应创建可分解/可切割的层(黄色区域)。用往复钩(紫色箭头)确认足够宽的层并在肝脏附近切割(红色箭头)。 (C,D)即使稍微粗心的收缩/反作用肝脏也可能容易导致右肾上腺(水箭和区域)周围出血和/或渗出。 (E)用手指进行精致且细节化的缩回/反作用,并用手(蓝色箭头)进行一般和粗略的缩回/反作用。通过腹腔镜的水平视图提供了沿着下腔静脉(绿色箭头)的极佳视野。手术区域通过腹腔镜(绿线)基本上扩散到前景。 (F)下腔静脉的侧壁裸露,然后短肝静脉和肝腔韧带可以镂空。即使稍微粗心的收缩/反作用也很容易导致下腔静脉出血和/或渗出(黑色箭头)。 (G)根据腹腔镜视力提供的概述,肝脏从膈肌移除而不会对肝脏或膈静脉造成任何损伤(蓝色箭头)。肝脏的裸露区域充分暴露。可分离/可切割层非常宽(黄色区域)并且有意切割尽可能靠近肝脏(红色箭头)。 (H)从下面观察也为切割可剥离/可切割层(黄色区域)BAL,肝脏裸露区域提供了一个很好的领域; HSE,钩形电极; IVC,下腔静脉; RAG,右肾上腺; SHV,短肝静脉
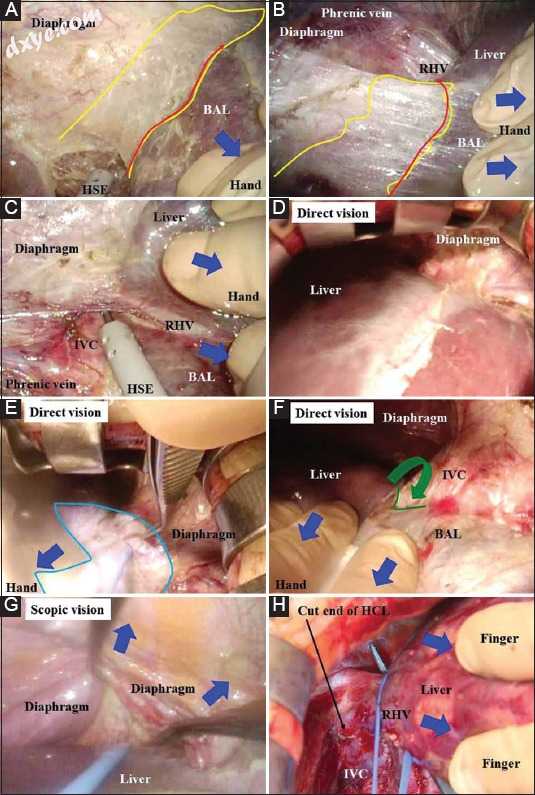
图4
(A,B)用手或手指同时收缩/反作用(蓝色箭头)和产生气腹压力的二氧化碳气体的显著浸润很好地产生可分解/可切割的层(黄色区域)。因为这层很宽,故意在解剖过程中尽可能靠近肝脏(红色箭头)。 (C)根据裸露的肝脏区域的暴露过程,仔细检测下腔静脉和右肝静脉的壁。 (D)如果在剑突下进行2cm伸展切口,直视也为右肝静脉检测提供了良好的手术视野。 (E)直视需要聚焦照明(水域)。 (F)检测右肝静脉和中肝静脉之间的划分(绿线)并解剖(绿色箭头)。 (G)来自中央和右侧的右肝静脉周围的切口通过视觉视觉连接,因为直视在右侧膈下空间仅提供有限的视野。 (H)切开肝腔韧带,露出右下腔静脉壁和右肝静脉的肝外边缘。然后将右肝静脉镂空BAL,肝脏裸露区域; HSE,钩形电极; IVC,下腔静脉; RHV,右肝静脉

图5
(A)将右肝静脉充分镂空,然后用Penrose引流管悬挂。 (B)用手指进行精致且细节化的缩回/反作用,并用手(蓝色箭头)进行一般和粗略的缩回/反作用。使用具有气腹的腹腔镜在左侧膈神经空间下提供了极好的手术区域。 (C)切下左肝三角韧带。 (D)从中央和左侧连接膜的切割端。应避免膈静脉受伤。可剥离/可切割层非常宽,右侧也是如此,应尽可能靠近肝脏(红色箭头)。 (E)具有伸展切口的直视为包括左肝静脉和肝中静脉悬吊的手术提供了优选的手术区域。直视需要聚焦照明(水域)。捏烧术技术可用于下腔静脉周围的解剖。 (F)检测中肝静脉和右肝静脉之间的分界(绿线)并通过下腔静脉的前壁(绿色箭头)解剖。进行足够的肝脏收缩(蓝色箭头)。 (G)下腔静脉壁应完全裸露在Spiegel's叶的上方。捏烧技术可以很好地实现这一目的。 (H)如果需要,将膈静脉结扎(黑色箭头)。应完成对结缔组织的完美解剖,特别是在Spiegel叶(黄色区域)HCL,肝腔韧带的上侧; HSE,钩形电极; IVC,下腔静脉; LHTL,左肝三角韧带; RAG,右肾上腺; RHV,右肝静脉
左侧移植物的采集程序(LSG)
以与上述程序相同的方式进行腹腔镜辅助的右叶移除。切下左肝三角韧带(图5B,C).C)。来自中央和左肝三角韧带侧的膜的切割端连接(图5D)。由气腹引起的肝脏和压力的同时收缩/反作用扩大了可分解/可切割层,并且应该尽可能有意地追踪该层尽可能接近肝脏(图5D)。然后移除伤口密封附件。具有上部伸展切口和聚焦照明的直视提供用于准备左HV(LHV)和MHV(图5E-G),G)的悬挂操作的手术区域,包括围绕LHV,MHV的解剖,或他们的共同渠道(图5E);检测MHV和RHV之间的分裂(图5F);和Spiegel叶的上侧有完整裸露的IVC壁的Arantius管道的骨架化和随后的结扎。捏烧技术效果很好[27](图5G)。侧位视力为膈静脉结扎提供了极好的放大场(图5H),骨架化和随后的Arantius管结扎(图6A),完全解剖了Spiegel's叶上侧的结缔组织(图5)。 5H,6B),6B),以及在Spiegel叶上侧的IVC壁的足够裸露(图6C,DD)。
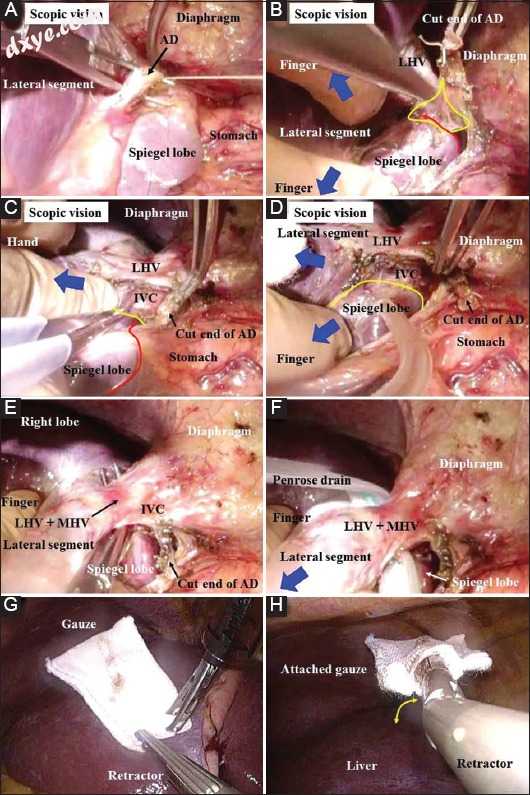
图6
(A)将Arantius导管结扎,然后切开。 (B-D)用手指进行精致且细节导向的缩回/反作用,并用手(蓝色箭头)进行一般和粗略的缩回/反作用。应完全解剖结缔组织(黄色区域)。 Spiegel的叶片周围的膜被切割(红线),并且该叶片的上侧完全裸露(黄线)。捏烧技术效果很好。 (E)下腔静脉壁在Spiegel's叶的上侧充分裸露。左肝静脉和中肝静脉的肝外边缘也是镂空的。 (F)这个公共通道悬挂着Penrose引流管。 (G)对于混合技术/纯腹腔镜手术,准备专门的纱布用于肝脏的收缩/反作用。 (H)连接到专用纱布上的铰接式扇形牵开器用于混合技术/纯腹腔镜手术。该装置是可弯曲的(黄色箭头)AD,Arantius'导管; IVC,下腔静脉; LHV,左肝静脉; MHV,中肝静脉
这些确保IVC壁充分暴露的程序对LSG很重要(图5G,H; H ;; 6B6B-D).D)。 LHV和MHV或LHV的共同通道被充分骨架化(图6E)。然后用Penrose引流管悬挂LHV的公共通道(图6F)。通过中线切口的横向腹腔镜视图提供了极好的放大视力,并且适用于LSG期间的采集。如果肝门的进一步手术困难,则增加下侧的伸展切口(图1B,CC)。
作者针对其他类型同种异体移植的程序
作者的LAS可应用于其他移植物类型,如单节段移植物[28],RLG与MHV [29]或右后移植物[26]。尽管这在技术上可能是困难且高风险的,因为切割表面设置为8​​厘米的中线切口,HV的悬挂操作使得即使通过较小的中线切口也能够进行安全的肝切除术[18,23]。
平滑过渡到PLS或HT的潜力
目前,在作者的机构中​​,通过气腹而不是开放式方法实现肝脏的粗略去除。在这里,根据作者接受HBP手术的患者进行肝切除术的PLS外科手术,作者验证并验证了LD中从LAS平稳过渡到HT或PLS的可能性[9,18,30,31]。专用纱布(Deltagauze; Osaki Medical Co.,Nagoya,Japan)(图6G)和铰接式扇形牵开器(图6H)允许足够的缩回/反作用而没有任何滑动(图7A)。此外,还提供用于PLS的高级设备(图7A,B).B)。 Laparosonic凝固剪(Harmonic Ace,Ethicon; Johnson&Johnson,Tokyo,Japan)是一种有用的手术刀,可提供可靠的止血(图7A)。带有吸力的纽扣形电极与软凝固系统(VIO; Erbe,Tübingen,德国)一起使用是安全止血的有效工具(图7B)。自我冲洗单极电极(IO advanced,Erbe)也可用于止血。助理外科医生使用两个镊子/牵开器移除肝脏(图7C)。在肝脏收缩期间,IVC的侧壁由腹腔镜凝固剪(图7D)裸露,然后短HV(SHV)和肝腔韧带被镂空(图7E),如para-IVC的水平视图通过柔性腹腔镜沿IVC提供极佳的放大视图(图7F)。该视图代表使用腹腔镜的一个优点(图3E,7E,7E,F).F。然后腹腔镜手术区域基本上扩散到前景,因此应该从前侧和下侧缝合意外伤害(包括出血)的缝合线,充分利用前部安全区域(图7G)。
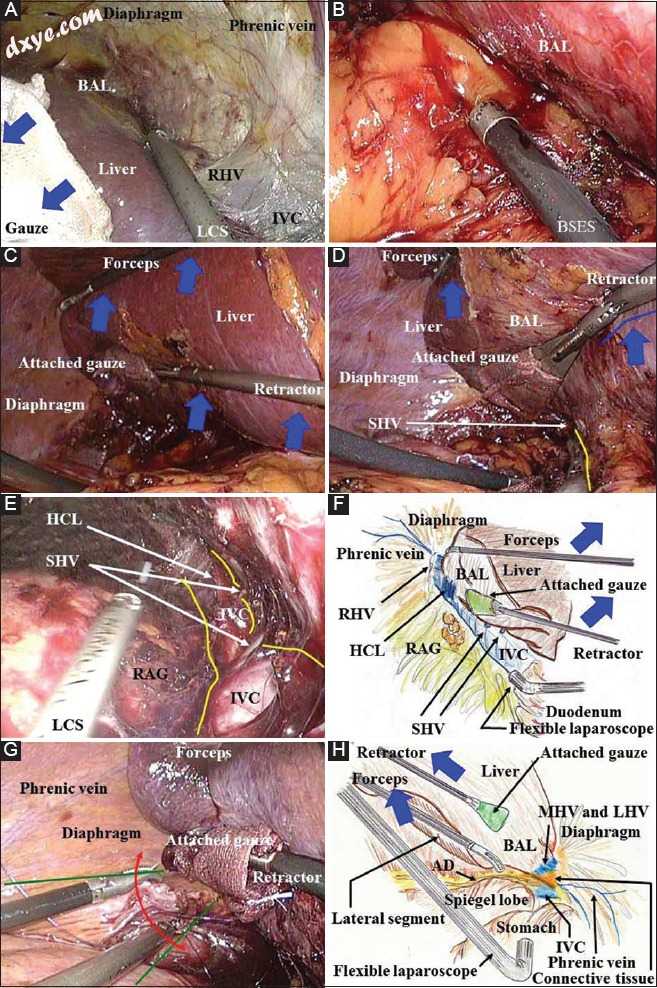
图7
(A)在混合技术/纯腹腔镜手术期间,该图中所示的专用牵开器确保肝脏的足够的收缩/反作用而没有任何滑动(蓝色箭头)。 Laparosonic凝固剪刀作为一种有用的手术刀,为下腔静脉周围的解剖和裸露的肝脏区域提供止血。为了在纯腹腔镜手术或混合技术中暴露肝脏的裸露区域,应该在侧背侧和尽可能远的头侧放置两个工作端口。 (B)在混合技术/纯腹腔镜手术期间,用抽吸和软凝固系统用按钮形电极摩擦出血血管或渗出组织是可靠止血的关键技术。 (C)在采用混合技术/纯腹腔镜手术切除右叶的外科手术过程中,助理外科医生应确保使用两个镊子/牵开器(蓝色箭头)充分收回肝脏。 (D,E)在混合技术/纯腹腔镜手术(蓝色箭头和线)期间由助手在肝脏收缩下,下腔静脉壁可以通过腹腔镜凝固剪(黄线)进行裸露。短肝静脉和肝腔韧带可以镂空。 (F)在混合技术/纯腹腔镜手术中,通过柔性腹腔镜从下腔静脉的水平视图提供沿下腔静脉的极佳视野。下腔静脉在平面视图中完全裸露。沿着腔静脉长度的这个视图对于腹腔镜是有利的。 (G)在混合技术/纯腹腔镜手术期间,腹腔镜手术区域基本上扩散到前景(绿线);因此,应使用前部安全区域从前侧和下侧(红色箭头)放置止血缝合线。 (H)通过柔性腹腔镜的侧视图提供了极好的放大视野。在结扎Arantius管并完全解剖结缔组织AD,Arantius'导管后,应在Spiegel's叶的上侧露出下腔静脉壁; BAL,裸露的肝脏区域; BSES,带抽吸的纽扣形电极; HCL,肝腔韧带; HSE,钩形电极; HT,混合技术; IVC,下腔静脉; LCS,腹腔镜凝固剪; LHV,左肝静脉; MHV,肝中静脉; PLS,纯腹腔镜手术; RAG,右肾上腺; RHV,右肝静脉; SHV,短肝静脉
讨论
作者认为作者的LAS是OS的扩展[9,12,13,17,18],尽管HALS被认为是腹腔镜手术的延伸[10]。基本上,作者的LAS是OS的可选扩展,充分利用了视觉视觉[9,18,21,24]。 LAS和HALS的概念彼此不同[9,10,28]。虽然HALS放弃了PLS或HT的优势[9,23],但作者的LAS有利于LD。虽然期望任何手术没有并发症是不现实的,但根据Clavien-Dindo分类的实际并发症在作者的LAS中没有观察到活体捐献者。
应该采集肝脏同种异体移植物而不会造成轻微损伤,因为即使是微小的损伤也可能导致LDLT受体的难治性并发症[11,18]。因此,移植物采集需要一定的切口,尽管LDLT外科医生试图尽量减少这种切口[18,21,24]。 LAS在诱导较小的腹壁损伤和更快的术后恢复方面是有利的[18,21,22,24]。令人惊讶的是,LD中30%至50%的并发症与腹壁损伤有关,包括切口疝,肠梗阻和慢性不适[5]。此外,60%的LD发生伤口相关症状,如伤口愈合,感觉异常或瘢痕增生,即使在OS术后1年,其中35%继续有投诉[18]。在LAS中,上中切口对于最小化腹部肌肉损伤是优选的[18,21,22,24],并且该切口可以允许进入所有节段[18,21,22,24]。熟练的外科医生逐渐扩大了他们的LD手术指征,按OS,LAS或HT和PLS的顺序[9,18,21,22,30,31]。随后,有趣的是,他们报告了有用的结果,故意遗漏横向或肋下切口确实使患者在手术后受益,并且在HT中出现意外伤害的患者可能遗漏中线切口[18,21,22]。作者同意这种中线切口的遗漏是有风险的[9,18,21,22],尽管有意遗漏横向或肋下切口是非常有益的[21,22]。虽然肋下切口疼痛,但这个切口提供了足够的手术区域[9,18]。合理的是,较少的镇痛作用可以缩短出院时间和早期重新融入社会[18,21,22]。另一方面,在比基尼系列中可隐藏的疤痕在一些拥有长海岸和漂亮海滩的国家中具有美容优势[5,31]。然而,如果皮肤切口远离上腹部,则遗憾的是LAS的一个优点(即,具有柔性腹腔镜视觉的直接接近)丢失。
与作者的PLS相比,作者的LAS可以提供​​可分解/可切割的层,其宽度使得不可能通过手或手指的同时使用缩回/反作用以及显著的二氧化碳气体渗透来最大程度地受到伤害(图3G,H,H,4A,4A,B).B)。即使较低的气腹压力足以在LAS中形成这一层。该层的足够宽度使得能够通过HSE进行简单切割(图2E-G,G,图3A-D,D,H,H,4C,4C,5D)。 5D)。基于这种高度的手术安全性,作者有意省略了横切口,这只需要从横膈膜上切除肝脏[23]。这种省略具有很大的优势,特别是对于经历RLG的LD,因为在RLG的操作系统中需要更长的横向切口而不是LSG [23,33]。
对于悬挂在RLG中的HV,重要的是建立RHV壁的裸露并且在创建气腹之前在RHV / MHV分区进行解剖(图1F,G).G)。对于悬挂在LSG中的HV,通过更小的中线切口联合使用腹腔镜是有效的。通过柔性腹腔镜的侧视图在PLS期间提供了极好的放大视野,甚至在食道的右侧也是如此(图7H)。根据这种观点,可以简单快速地执行涉及HV悬挂的重要程序的直接方法(图5H,6-D)。
目前的腹腔镜器械发育良好,但每种器械都应以正确的方式使用[9,34]。许多设备都可用,外科医生应遵循制造商的指示以避免任何故障[9,34]。外科医生还必须确保他们对如何使用这些设备的知识定期更新[34]。在HV重建中,移植物HV的边缘对于确保可靠的吻合和优异的流出是重要的[35]。在PLS期间可以缩短HV裕度,因为HV将由内窥镜切割。作者为LAS [Proximate TX(TX30V),白色墨盒(XR30V)采用专用设备; Ethicon,Johnson&Johnson]和这种装置有助于将吻合器正确放置在组织上而无需切割。该装置仅关闭供体IVC的侧面;它永远不会切割移植物HV。因此,保留了移植物的HV边缘。作者不能通过腹腔镜端口应用这种装置,这就是为什么作者在上腹部做中线切口以及为什么作者不在LD中挑战PLS。
仅凭经验不足以实现腹腔镜手术的安全性[3,34,36]。基于3D成像的术前解剖分析对于成功的HBP手术至关重要,包括LAS,HT和PLS(图1A)。如果外科医生自己创建模拟图像,术前解剖分析还可以精确评估肝脏残余和移植物体积,并有效规划实际手术程序[19,37] [34]。合理的是,移植物体积从不涉及尾状叶,因为尾状叶的PV和/或胆管分支通常在肝门周围的外科手术过程中结扎。此外,排出尾状流入物的SHV也被结扎。尽管LAS提供了围绕IVC的良​​好视野,但是通过结扎肝腔韧带和所有SHV去除整个尾状叶将需要更长的手术时间(图3F,7E,7E,F).F。如果移植物采集延迟,则在LDLT期间包含无肝期的较长等待时间将导致严重问题,包括LDLT受体中的凝血病和血液动力学不稳定性。在LDLT期间,捐赠手术应该毫不拖延地进行。因此,在没有尾状叶的情况下术前评估移植物体积是精确预测功能性移植物体积的实际方法,在受体手术期间是稳定的过程,以及作者的LAS的更平滑过程。
OS和PLS所需的手术技术完全不同[1-3,10]。 PLS中的外科手术应该仔细考虑并建立良好[1,3,9,11,15,16],作者应该考虑PLS通常需要比OS更长的手术时间[10]。一些研究人员报告了LD的PLS的优势点,例如失血少,疼痛少,住院时间短,早期重新融入社会[3,5,6,14]。作者也理解许多LDLT外科医生希望尝试PLs用于LD [1,5,7,9,11,14]。一些LDLT外科医生实际上记录了RLG和LSG的PLS [5,7,14]。先进的设备是可靠的(图6G,,H,H,7A,7A,B),B),灵活的腹腔镜提供了极好的放大视图(图7D- -F,F ,, 1H).H)。但是,外科医生应该熟悉PLS [3,9,38]。这个过程的关键是暴露右侧膈下区域的肝脏裸露区域,其中两个工作端口尽可能朝向侧背侧(图1H)放置,并尽可能朝向头侧沿着上中线(图1B)[38]。辅助外科医生应在外科手术过程中充分缩回肝脏(图7C,D)D),以沿着IVC保持良好的腹腔镜视力(图7E,F).F。捐赠手术期间血管意外出血对外科医生来说是一场噩梦,因为应该避免输血。在OS中,放置在出血点远侧并随后抓住该缝合线的缝合线立即改善了这种情况。另一方面,腹腔镜手术区域基本上扩散到前景;因此,插入用于止血的缝合线的针应在PLS期间从下方进入前景(图7G)。在PLS中,通过带有软凝固系统抽吸的按钮形电极摩擦出血血管或渗出组织是可靠止血的关键技术(图7B),因为有效的出血控制在PLS中非常重要[9] ]。自冲洗单极电极(IO先进,Erbe)也可用于止血,特别是对于切割肝脏表面的止血。
虽然没有关于PLS肝切除术后最佳引流放置的确定性研究,但作者通常仅在术后早期放置闭合引流管。排泄物中的胆红素和淀粉酶水平可以为PLS后的临床决策提供信息。引流管应自动放置,作者认为通过腹腔镜端口的刺伤短期放置引流管不是侵入性的,但对PLS后患者的术后疗程有效。
成为声望卓著的腹腔镜外科医生需要在优秀教学下旷日持久的学习曲线。经过董事会认证和受过良好教育的腹腔镜外科医生可以毫无延迟地使用HT治疗LD [9,31],而作者自己机构的这些外科医生允许进一步逐步引入先进的腹腔镜手术[2,3]。考虑到作者机构的现状,从LAS到HT的谨慎进展是作者目前的目标,因为作者同意HT和HALS在未来可以作为PLS的桥梁[10]。虽然作者还没有为LDs中的PLS做好准备[15,16],但HT是一种安全的可能性,它是一种涉及PLS的联合手术,直到准备悬挂操作和随后使用腹腔镜直接进行操作的OS。 LDLT外科医生应该在未来十年内走向何方? LDLT外科医生拥有非常广泛的知识和技术前沿。
参考:
Comprehensive guide to laparoscope-assisted graft harvesting in live donors for living-donor liver transplantation: perspective of laparoscopic vision
1. Park JI, Kim KH, Lee SG. Laparoscopic living donor hepatectomy: a review of current status. J Hepatobiliary Pancreat Sci. 2015;22:779–788. [PubMed] [Google Scholar]
2. Ciria R, Cherqui D, Geller DA, Briceno J, Wakabayashi G. Comparative short-term benefits of laparoscopic liver resection:9000 cases and climbing. Ann Surg. 2016;263:761–777. [PubMed] [Google Scholar]
3. Wakabayashi G, Cherqui D, Geller DA, et al. Recommendations for laparoscopic liver resection: a report from the second international consensus conference held in Morioka. Ann Surg. 2015;261:619–629. [PubMed] [Google Scholar]
4. Tsinberg M, Tellioglu G, Simpfendorfer CH, et al. Comparison of laparoscopic versus open liver tumor resection: a case-controlled study. Surg Endosc. 2009;23:847–853. [PubMed] [Google Scholar]
5. Samstein B, Griesemer A, Cherqui D, et al. Fully laparoscopic left-sided donor hepatectomy is safe and associated with shorter hospital stay and earlier return to work: A comparative study. Liver Transpl. 2015;21:768–773. [PubMed] [Google Scholar]
6. Bekheit M, Khafagy PA, Bucur P, et al. Donor safety in live donor laparoscopic liver procurement: systematic review and meta-analysis. Surg Endosc. 2015;29:3047–3064. [PubMed] [Google Scholar]
7. Rotellar F, Pardo F, Benito A, et al. Totally laparoscopic right-lobe hepatectomy for adult living donor liver transplantation: useful strategies to enhance safety. Am J Transplant. 2013;13:3269–3273. [PubMed] [Google Scholar]
8. Lin NC, Nitta H, Wakabayashi G. Laparoscopic major hepatectomy: a systematic literature review and comparison of 3 techniques. Ann Surg. 2013;257:205–213. [PubMed] [Google Scholar]
9. Wakabayashi G, Nitta H, Takahara T, Shimazu M, Kitajima M, Sasaki A. Standardization of basic skills for laparoscopic liver surgery towards laparoscopic donor hepatectomy. J Hepatobiliary Pancreat Surg. 2009;16:439–444. [PubMed] [Google Scholar]
10. Hasegawa Y, Koffron AJ, Buell JF, Wakabayashi G. Approaches to laparoscopic liver resection: a meta-analysis of the role of hand-assisted laparoscopic surgery and the hybrid technique. J Hepatobiliary Pancreat Sci. 2015;22:335–341. [PubMed] [Google Scholar]
11. Soubrane O, de Rougemont O, Kim KH, et al. Laparoscopic living donor left lateral sectionectomy: A new standard practice for donor hepatectomy. Ann Surg. 2015;262:757–761. [PubMed] [Google Scholar]
12. Ishizawa T, Hasegawa K, Kokudo N. Laparoscopy-assisted hybrid left-side donor hepatectomy: is it truly less invasive for living donors? World J Surg. 2014;38:1560–1561. [PubMed] [Google Scholar]
13. Marubashi S, Wada H, Kawamoto K, et al. Laparoscopy-assisted hybrid left-side donor hepatectomy: rationale for performing LADH. World J Surg. 2014;38:1562–1563. [PubMed] [Google Scholar]
14. Scatton O, Katsanos G, Boillot O, et al. Pure laparoscopic left lateral sectionectomy in living donors: from innovation to development in France. Ann Surg. 2015;261:506–512. [PubMed] [Google Scholar]
15. Borle DP, Bharathy KG, Kumar S, Pamecha V. Laparoscopic living donor left hepatectomy: donor safety remains the overriding concern. Am J Transplant. 2014;14:735. [PubMed] [Google Scholar]
16. Troisi RI. Open or laparoscopic living donor liver hepatectomy: still a challenging operation!Am J Transplant. 2014;14:736. [PubMed] [Google Scholar]
17. Suh KS, Yi NJ, Kim T, et al. Laparoscopy-assisted donor right hepatectomy using a hand port system preserving the middle hepatic vein branches. World J Surg. 2009;33:526–533. [PubMed] [Google Scholar]
18. Nitta H, Sasaki A, Fujita T, et al. Laparoscopy-assisted major liver resections employing a hanging technique: the original procedure. Ann Surg. 2010;251:450–453. [PubMed] [Google Scholar]
19. Ohshima S. Volume analyzer SYNAPSE VINCENT for liver analysis. J Hepatobiliary Pancreat Sci. 2014;21:235–238. [PubMed] [Google Scholar]
20. Milsom J, Trencheva K, Monette S, et al. Evaluation of the safety, efficacy, and versatility of a new surgical energy device (THUNDERBEAT) in comparison with Harmonic ACE, LigaSure V, and EnSeal devices in a porcine model. J Laparoendosc Adv Surg Tech A. 2012;22:378–386. [PubMed] [Google Scholar]
21. Soyama A, Takatsuki M, Hidaka M, et al. Hybrid procedure in living donor liver transplantation. Transplant Proc. 2015;47:679–682. [PubMed] [Google Scholar]
22. Soyama A, Takatsuki M, Hidaka M, et al. Standardized less invasive living donor hemihepatectomy using the hybrid method through a short upper midline incision. Transplant Proc. 2012;44:353–355. [PubMed] [Google Scholar]
23. Inomata Y, Egawa H. Tanaka K, Inomata Y, Kaihara S, editors. Surgical procedure for right lobectomy. Living-donor liver transplantation. Surgical techniques and innovations. Prous Science:Barcelona. 2003:43–57. [Google Scholar]
24. Eguchi S, Takatsuki M, Soyama A, et al. Elective living donor liver transplantation by hybrid hand-assisted laparoscopic surgery and short upper midline laparotomy. Surgery. 2011;150:1002–1005. [PubMed] [Google Scholar]
25. Nabeshima M, Ogawa K. Tanaka K, Inomata Y, Kaihara S, editors. Modalities for evaluation. Living-donor liver transplantation. Surgical techniques and innovations. Prous Science:Barcelona. 2003:7–28. [Google Scholar]
26. Hori T, Kirino I, Uemoto S. Right posterior segment graft in living donor liver transplantation. Hepatol Res. 2015;45:1076–1082. [PubMed] [Google Scholar]
27. Fujita S, Inomata Y. Tanaka K, Inomata Y, Kaihara S, editors. Surgical procedure for recipient hepatectomy. Living-donor liver transplantation. Surgical techniques and innovations. Prous Science:Barcelona. 2003:67–74. [Google Scholar]
28. Shehata MR, Yagi S, Okamura Y, et al. Pediatric liver transplantation using reduced and hyper-reduced left lateral segment grafts: a 10-year single-center experience. Am J Transplant. 2012;12:3406–3413. [PubMed] [Google Scholar]
29. Kasahara M, Takada Y, Fujimoto Y, et al. Impact of right lobe with middle hepatic vein graft in living-donor liver transplantation. Am J Transplant. 2005;5:1339–1346. [PubMed] [Google Scholar]
30. Takahara T, Wakabayashi G, Hasegawa Y, Nitta H. Minimally invasive donor hepatectomy: evolution from hybrid to pure laparoscopic techniques. Ann Surg. 2015;261:e3–4. [PubMed] [Google Scholar]
31. Hasegawa Y, Nitta H, Sasaki A, et al. Laparoscopic left lateral sectionectomy as a training procedure for surgeons learning laparoscopic hepatectomy. J Hepatobiliary Pancreat Sci. 2013;20:525–530. [PubMed] [Google Scholar]
32. Cardinal JS, Reddy SK, Tsung A, Marsh JW, Geller DA. Laparoscopic major hepatectomy: pure laparoscopic approach versus hand-assisted technique. J Hepatobiliary Pancreat Sci. 2013;20:114–119. [PMC free article] [PubMed] [Google Scholar]
33. Ueda M, Kozaki K. Tanaka K, Inomata Y, Kaihara S, editors. Surgical procedure for left lateral segmentectomy and left lobectomy. Living-donor liver transplantation. Surgical techniques and innovations. Prous Science:Barcelona. 2003:33–42. [Google Scholar]
34. Hori T, Masui T, Kaido T, et al. Laparoscopic distal pancreatectomy with or without preservation of the spleen for solid pseudopapillary neoplasm. Case Rep Surg. 2015;2015:487639. [PMC free article] [PubMed] [Google Scholar]
35. Lee SG. A complete treatment of adult living donor liver transplantation: a review of surgical technique and current challenges to expand indication of patients. Am J Transplant. 2015;15:17–38. [PubMed] [Google Scholar]
36. Strasberg SM, Hertl M, Soper NJ. An analysis of the problem of biliary injury during laparoscopic cholecystectomy. J Am Coll Surg. 1995;180:101–125. [PubMed] [Google Scholar]
37. Hallet J, Gayet B, Tsung A, Wakabayashi G, Pessaux P 2nd International Consensus Conference on Laparoscopic Liver Resection Group. Systematic review of the use of pre-operative simulation and navigation for hepatectomy: current status and future perspectives. J Hepatobiliary Pancreat Sci. 2015;22:353–362. [PubMed] [Google Scholar]
38. Ikoma N, Itano O, Oshima G, Kitagawa Y. Laparoscopic liver mobilization: tricks of the trade to avoid complications. Surg Laparosc Endosc Percutan Tech. 2015;25:e21–23. [PMC free article] [PubMed] [Google Scholar] |


