马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
阑尾炎穿孔腹腔镜阑尾切除术后嗜麦芽寡养单胞菌引起的腹腔脓肿快速增长的不寻常病例
案例报告
概要
介绍:
由于嗜麦芽寡养单胞菌(S maltophilia)感染引起的腹腔脓肿是一种非常罕见的临床表现。 嗜麦芽糖杆菌是葡萄糖非发酵,需氧,革兰氏阴性,移动和生物膜形成细菌。 它是一种机会性病原体和不常见的感染原因。 呼吸道感染(肺炎)和血流感染(菌血症)是嗜麦芽窄食单胞菌感染最常见的临床表现。
结论:
本病例报告描述了一例急性增长,极大的腹腔内脓肿(抗生素治疗1周内),这是在腹腔镜阑尾切除术治疗穿孔性阑尾炎2周后检测到的,是由多重耐药的嗜麦芽糖杆菌感染引起的。
关键词:腹腔脓肿,嗜麦芽寡养单胞菌,手术
1.简介
嗜麦芽寡养单胞菌(S malothilia)是一种葡萄糖非发酵,需氧,革兰氏阴性,移动和生物膜形成细菌。[1]世界卫生组织最近将嗜麦芽寡养病列为医院环境中主要的多药耐药生物之一。[2]嗜麦芽窄食单位通常被认为是低毒力的生物体和机会致病菌,特别是在免疫功能低下的宿主中。嗜麦芽寡养单胞菌的感染率非常罕见,一般人群中嗜麦芽寡养单胞菌的流行率为1.3%至1.68%[3]。呼吸道感染(肺炎)和血流感染(菌血症)是嗜麦芽寡养单胞菌感染最常见的临床表现[1,4]。不常见的表现是尿路感染,胆道感染,骨和关节感染,皮肤和软组织感染腹膜炎,腹膜炎,伤口感染,眼内炎,脑膜炎和心内膜炎。[1,4]嗜麦芽窄食单胞菌感染的诱发因素众所周知,包括留置导尿管(中心静脉导管和尿道或胆道导管)机械通气,近期手术,恶性肿瘤(尤其是血液系统恶性肿瘤,重症监护室入院,器官移植,皮质类固醇或免疫抑制药物,中性粒细胞减少症和以前的抗生素使用。[5]由于嗜麦芽寡养单胞菌感染引起的腹腔脓肿的形成是非常罕见的临床表现。由于穿孔性阑尾炎引起的腹腔镜阑尾切除术后由嗜麦芽寡糖感染引起的极大腹腔脓肿的快速生长(1周内)是非常罕见的。
2.病例报告
一名14岁男孩患有3天间歇性腹痛和发烧病史。他在2周前在同一家医院接受了腹腔镜阑尾切除术,因为穿孔性阑尾炎(图1).1)。他也有自闭症谱系障碍病史,并且在过去的3年里一直接受药物治疗。出院后两周状况良好,他因腹痛和发烧而前往急救中心。实验室测试显示,白细胞计数为22,180个细胞/ mm3,C反应蛋白水平为23.35 mg / dL(参考范围,0-0.5 mg / dL),血红蛋白计数为12.4 g / dL。其他实验室研究结果显示没什临床症状为发热(38.6°C)和轻度腹痛。腹部盆腔计算机断层扫描(CT)扫描显示在回肠区域形成小尺寸脓肿(2-3cm)(图2).2)。患者入院,静脉注射抗生素治疗1周。静脉内(IV)抗生素是4.5g /小瓶他唑巴坦(0.5g)和哌拉西林钠(4g),每6小时施用一次,甲硝唑(500mg / 100mL / bt)每8小时施用一次。对小尺寸脓肿袋进行1周抗生素治疗后,随访CT扫描显示,回肠区域的初始小尺寸脓肿较小。然而,沿右前肾旁间隙和肝下空间存在新发展的极大脓肿(约7-8cm)形成(图3).3)。对脓肿引流进行急诊剖腹探查,检查阑尾切除部位的渗漏情况。术中发现在盲肠附近的回肠区域有一个小脓肿口袋(1-2厘米)。阑尾切除部位正常,无特异性发现或渗漏。然而,在肝床,横结肠和胃之间有一个巨大的脓肿口袋。该脓肿袋显示出对肝床,横结肠,胃和网膜的严重粘连(图4).4)。回肠区域的脓肿消失了。然而,巨大的脓肿口袋因​​其粘连而无法消除。因此,使用电烙装置使其破裂,然后插入封闭的排水管。手术后一周,随访CT扫描显示巨大的脓肿口袋较小但仍然存在。在超声引导下插入经皮引流导管。脓肿引流培养显示出许多S型嗜麦芽糖杆菌。来自脓肿的培养物每隔2天进行一次。所有培养物的结果通过自动化系统(VITEK 2微生物鉴定和抗生素敏感性[ID / AST]测试系统;bioMérieuxS.A.69280Marcy l'Etoile,France)进行。加入IV三甲基嘧啶/磺胺甲恶唑,持续2周。 2周后,随访CT扫描显示完全改善,患者出院并恢复良好。
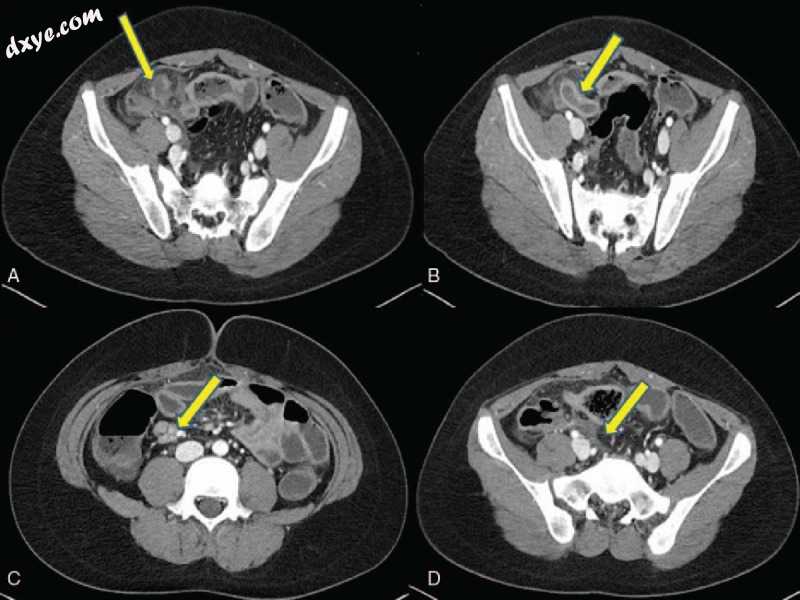
图1
初步计算机断层扫描发现:(A,B)急性阑尾炎,(C)回肠区域淋巴结肿大,(D)回肠区域液体收集。
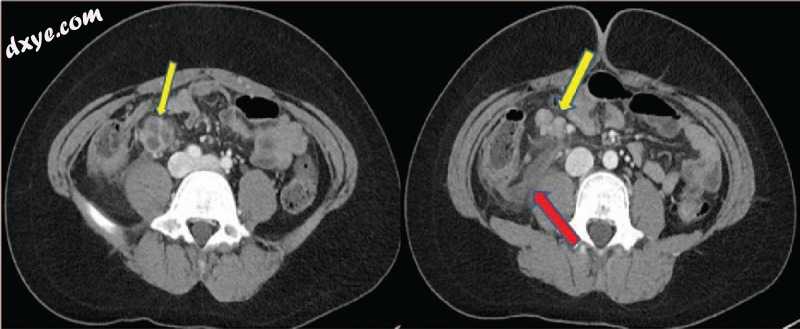
图2
腹腔镜阑尾切除术后2周后的计算机断层扫描:(A)回肠区域的脓肿袋,(B)淋巴结肿大(黄色箭头),回肠区域的液体收集(红色箭头)。
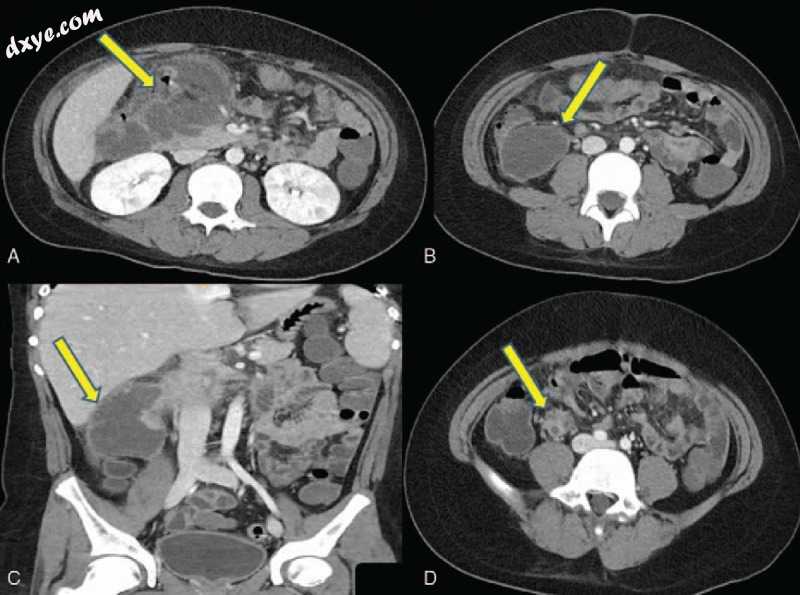
图3
(A-C)快速生长的脓肿形成以及肝下区域和右前肾旁空间(箭头)。 (D)在回肠区域的初始脓肿口袋,改变较小的尺寸(箭头)。
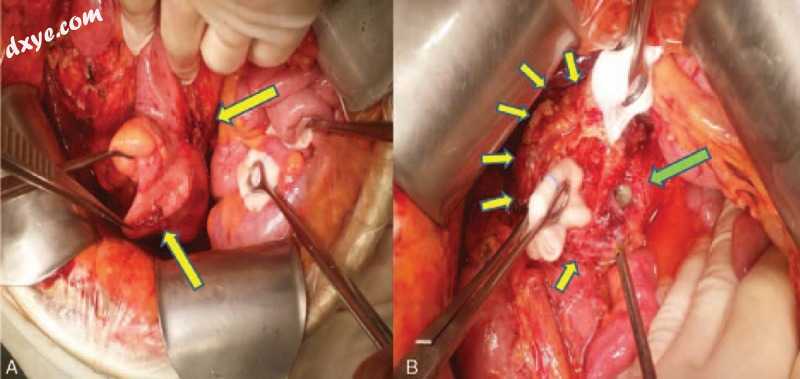
图4
(A)阑尾切除部位正常(左箭头),位于回肠区域(右箭头)的初始脓肿袋位置。 (B)具有严重粘连的脓肿形成(黄色箭头),电烙装置使脓肿袋破裂(绿色箭头)。
3.讨论
一项对1817名患者的回顾性研究报道,3口腹腔镜阑尾切除术后内部形成的发生率为1.5%,从腹腔镜阑尾切除术到腹腔脓肿检查的平均间隔为12.9天[6]。同一项研究报道,腹腔镜阑尾切除术后腹腔脓肿形成的危险因素是腹膜冲洗和腹膜引流不存在[6]。在本例中,在腹腔镜阑尾切除术期间进行腹膜冲洗(约100cc),并插入腹膜引流管。在本例中,在对穿孔性阑尾炎进行腹腔镜阑尾切除术后2周,在回盲区检测到小的腹腔内脓肿。有趣的是,尽管采用了抗生素治疗,但在回盲区治疗小脓肿后形成了巨大的腹腔内脓肿。
嗜麦芽糖杆菌不被认为是高毒力的。它主要引起医院获得性感染,特别是在免疫功能低下的患者中。然而,由于微生物固有的多重耐药性,包括对β-内酰胺类抗生素,氨基糖苷类,微生物的院内定植以及它们的机会致病性,S型嗜麦芽寡糖感染增加[7]。由于细菌对各种抗生素的固有抗性,对嗜麦芽寡糖感染的治疗很困难。[7]对嗜麦芽糖杆菌的选择治疗是甲氧苄啶/磺胺甲恶唑,氟喹诺酮是提出的替代方案。甲氧苄啶/磺胺甲恶唑仍是最有效的抗嗜麦芽糖杆菌的抗菌药物,总体易感率高于90%。[8]由于对大多数抗生素具有广泛抗性,包括β-内酰胺类抗生素,大环内酯类和氨基糖苷类,因此对嗜麦芽寡糖引起的感染的抗菌治疗选择有限。
它仍然对替卡西林/克拉维酸,头孢他啶,米诺环素,左氧氟沙星,甲氧苄啶/磺胺甲恶唑和氯霉素敏感[8]。本病例患者在IV抗生素治疗期间(他唑巴坦0.5g,哌拉西林钠4g,甲硝唑500mg / 100mL)治疗1周后出现新的脓肿。在用甲氧苄啶/磺胺甲恶唑静脉内治疗2周后,患者完全康复。嗜麦芽糖杆菌与高发病率和死亡率相关,从21%到69%不等。[9]根据先前的研究,嗜麦芽窄食杆菌菌血症患者死亡的危险因素是脓毒症相关的器官衰竭评估评分和中心静脉导管的切除,如多变量分析所示[10]。
本案的三个方面使其不同寻常。首先,在IV抗生素治疗期间,在另一个部位的小腹内脓肿中发生了巨大的腹腔内脓肿。其次,极大的腹腔脓肿形成非常迅速(1周内)。第三,来自脓肿液的培养物显示出嗜麦芽糖杆菌。在嗜麦芽寡糖感染的临床表现中,腹腔脓肿的形成是非常罕见且不寻常的临床特征。目前尚不清楚嗜麦芽寡养单胞菌存在的原因。该病例提供了嗜麦芽窄食单位在胃肠道定植的可能性,因为胃肠道是最可能的后阑尾切除术腹腔脓肿的来源。
脚注
缩写:CT =计算机断层扫描,IV =静脉注射。
参考:
Unusual case of rapid growing intraabdominal abscess caused by Stenotrophomonas maltophilia after laparoscopic appendectomy due to perforated appendicitis
A case report
[1] Looney WJ, Narita M, Muhlemann K. Stenotrophomonas maltophilia: an emerging opportunist human pathogen. Lancet Infect Dis 2009;9:312–23. [PubMed] [Google Scholar]
[2] Brooke JS. New strategies against Stenotrophomonas maltophilia: a serious worldwide intrinsically drug-resistant opportunistic pathogen. Expert Rev Anti Infect Ther 2014;12:1–4. [PubMed] [Google Scholar]
[3] Sader HS, Farrell DJ, Flamm RK, et al. Antimicrobial susceptibility of Gram-negative organisms isolated from patients hospitalized with pneumonia in US and European hospitals: results from the SENTRY Antimicrobial Surveillance Program, 2009–2012. Int J Antimicrob Agents 2014;43:328–34. [PubMed] [Google Scholar]
[4] Falagas ME, Kastoris AC, Vouloumanou EK, et al. Community-acquired Stenotrophomonas maltophilia infections: a systematic review. Eur J Clin Microbiol Infect Dis 2009;28:719–30. [PubMed] [Google Scholar]
[5] del Toro MD, Rodríguez-Bano J, Herrero M, et al. Clinical epidemiology of Stenotrophomonas maltophilia colonization and infection: a multicenter study. Medicine (Baltimore) 2002;81:228–39. [PubMed] [Google Scholar]
[6] Cho J, Park I, Lee D, et al. Risk factors for postoperative intra-abdominal abscess after laparoscopic appendectomy: analysis for consecutive 1,817 experiences. Dig Surg 2015;32:375–81. [PubMed] [Google Scholar]
[7] Chang YT, Lin CY, Chen YH, et al. Update on infections caused by Stenotrophomonas maltophilia with particular attention to resistance mechanisms and therapeutic options. Front Microbiol 2015;6:893. [PMC free article] [PubMed] [Google Scholar]
[8] Falagas ME, Valkimadi PE, Huang YT, et al. Therapeutic options for Stenotrophomonas maltophilia infections beyond co-trimoxazole: a systemic review. J Antimicrob Chemother 2008;62:889–94. [PubMed] [Google Scholar]
[9] Senol E, DesJardin J, Stark PC, et al. Attributable mortality of Stenotrophomonas maltophilia bacteremia. Clin Infect Dis 2002;34:1653–6. [PubMed] [Google Scholar]
[10] Jeon YD, Jeong WY, Kim MH, et al. Risk factors for mortality in patients with Stenotrophomonas maltophilia bacteremia bacteremia. Medicine (Baltimore) 2016;95:e4375. [PMC free article] [PubMed] [Google Scholar] |


