马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
腹腔镜胆囊切除术于20世纪80年代中期被引入外科手术中,是常规胆囊切除术的常用替代方法。它的主要优点是侵入性较小,从而缩短了住院时间并加快了恢复速度。然而,两种手术的并发症是可比较的并且包括多个器官和组织。本文介绍了腹腔镜胆囊切除术后手术床的超声表现以及与此相关的并发症。在手术后的第一周,在某些患者中,在移除的胆囊床中存在多达60ml的液体应该被认为是正常的。液体会逐渐吸收。在单个病例中,在腹膜腔中检测到少量的液体,这也不应该是警报。二氧化碳在两天内从腹膜腔吸收。手术期间留下的止血材料抑制了胆囊切除术后手术床的超声评估。它的陈述可能类似脓肿。在这种情况下,决定性检查是磁共振成像,但不是计算机断层扫描。另一方面,快速积聚肝脏周围的液体是一种令人担忧的症状,特别是当血液供应不足或出现腹膜刺激症状时。根据患者病情恶化的可疑原因,必须进行紧急计算机断层扫描血管造影,腹腔血管造影或内镜逆行胰胆管造影或磁共振胰胆管造影。流体收集的特征可以通过其超声引导的穿刺来确定。该程序允许抽吸流体和放置引流管。此外,腹腔镜胆囊切除术后经腹超声检查可能有助于鉴别:右侧下区域的结石,可能结石的胆囊残留碎片,未诊断的胆总管结石,现有的胆汁淤积,肝动脉假性动脉瘤,门静脉血栓形成和血肿等。以及腹壁的疝气。此外,超声检查有助于识别腹部皮层中的最佳部位,这使得能够无碰撞地进入腹膜腔。
关键词:腹腔镜胆囊切除术,超声检查,手术床,并发症,诊断
腹腔镜胆囊切除术已成为治疗单纯性胆石症的基本方法。开放性胆囊切除术适用于存在剧烈炎症的病例。这特别是指Calot三角区的炎症,怀疑患有坏疽性胆囊炎,壁穿孔和胆囊肿瘤病变的情况,以及胆囊和胃肠道之间的瘘管以及病理性脂肪沉积患者的病例。上腹部粘连(1)。除了传统的经腹超声(US)之外,这种并发症的诊断需要应用其他成像技术,例如内窥镜超声,计算机断层扫描,内窥镜逆行胰胆管造影术,磁共振胰胆管造影术(MRCP)或腹腔/肠系膜血管造影术。目前,腹腔镜胆囊切除术(LCH)是一种黄金标准,因为住院时间缩短,并且减少了涉及腹部外科手术的外科手术的不利因素。然而,两种方法(开放式和腹腔镜)的并发症指标具有可比性(2-4)。
本文提出了一系列变化,这些变化通过超声在LCH后的手术床检查可视化,这与临床观点无关,并且揭示了与该方法相关的并发症。
LCH后不久发生术后部位
1991年,康等人。 (4)证实在53%的病例中,在LCH后的术后床中发现1-60ml液体(平均4ml)。以前的数据表明,这种迹象在12-24%的病例中呈现红色。在这些患者的主要患者中(4),液体是消声性的或低血压的(图1)。仅有30%的人表现出高回声,这可以通过新鲜血液,网膜或肠系膜的存在来解释。 106名患者中有11名(10.4%)在腹膜或胸膜腔中也出现少量游离液。此外,Bersani和Lallemand(5)在手术后第3天,第5天,第7天和第9天监测LCH后手术床内游离液的图像,并同意在2-4天内吸收。 McAlister(6)报告了类似的观察结果。上述作者(4,5)和Müller等人。 (7)认为在手术后的第一天进行常规的美国检查是不合理的,因为它的特点是灵敏度低(8%),并且有大量的假阳性结果,导致住院时间延长。其他作者报告LCH后美国检查的敏感性较高(8,9)。因此,可以假设当怀疑出现由血液供应不足或腹膜刺激症状引起的并发症时,超声检查是合理的,例如:胆管损伤,急性出血和胆汁泄漏到腹腔。腹腔镜手术后,这种并发症发生率为3-4%(7)。超声检查不允许对游离液(血肿,胆汁或脓肿的收集)的特征进行可靠的分析。这种技术中的图像被气体隐藏,但二氧化碳吸收很快 - 在两天内(8),空气可能持续数天(图2)。此外,LCH后保留的止血材料使图像变得复杂,类似于脓肿。在这种情况下,磁共振成像是有帮助的,因为饱和的血液损伤产品的止血材料在T2加权图像中产生低信号(10)。当对LCH床中的液体收集特征持续存在疑虑时,可以进行超声引导穿刺以用于诊断或治疗目的(抽空,引流插入)(11,12)。

图1
腹腔镜胆囊切除术后一天。 在距离标记所示的胆囊床中可以看到少量的液体

图2
腹腔镜胆囊切除术后一天。腹膜中的气体(箭头)禁止评估手术床。 L - 肝脏
在LCH之后不应该引起怀疑的患者的恒定图像是一组强烈的反射,随后在肝门中出现彗星尾部假象(图3) - 它对应于金属夹。逐渐地,在手术后数周或数月之后,胆囊床中将出现宽度为几十到十几毫米的高回声瘢痕带(图4)。在某些情况下,手术床被十二指肠球所占据,经常充满气体,这掩盖了超声对胆总管的呈现。有时,十二指肠球充满了类似液体蓄水池的液体(图5)。在这种情况下,这种“病变”中蠕动的可视化或其他内容的出现将是一个决定性的信号(图6)。一些研究人员在LCH后不久,观察到胆总管轻微扩张而没有可检测到的障碍(11)。另一个发现是细管,长度为几毫米到30毫米(图7),这对应于整个胆囊管的碎片或整个胆囊管,在LCH期间很少完全去除(13)。手术床评估中的诊断问题由胆囊床构成,其中病理形态学家检测到低级别胆囊癌。在这种情况下,一些外科医生认为有必要对肝脏进行楔形切除,包括粘附在胆囊窝上的IV和V段。其他人决定仅在成像检查中观察手术床(图8)。早期检测正电子发射断层扫描 - 计算机断层扫描(PET / TK)复发仅在手术后6周,炎症反应消退和组织愈合时才可行(14)。在超声的检查中,病变被诊断为延迟 - 当它们过滤肝脏时,当病毒在其中发生变化时,或者在肝门部出现肿大的淋巴结时。
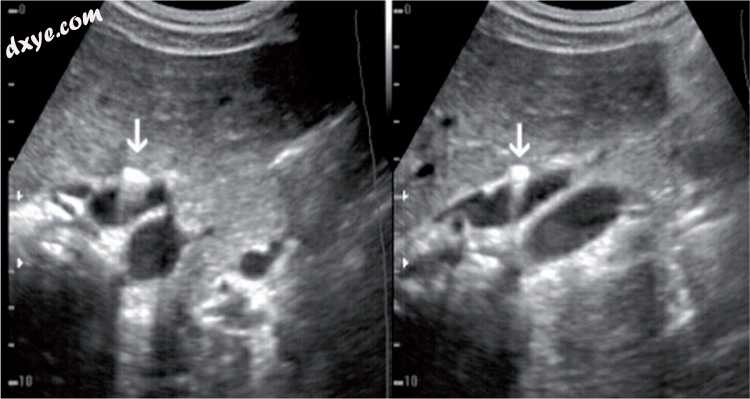
图3
腹腔镜胆囊切除术后一年。 在胆囊床中,在两个视图中,可以看到金属手术夹(箭头)
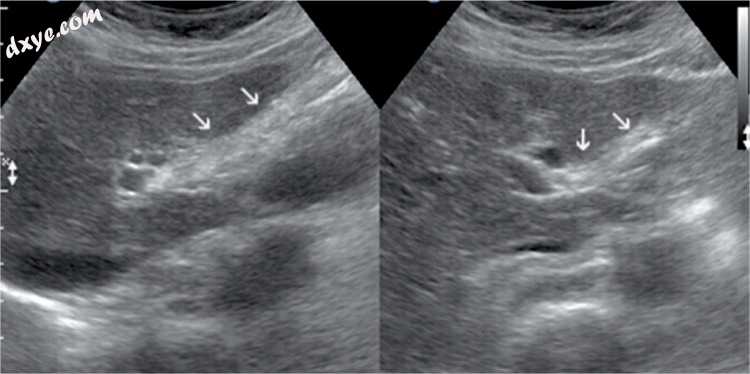
图4
腹腔镜胆囊切除术后8个月。 在胆囊球中,在两个视图中,可以看到高回声带(箭头)
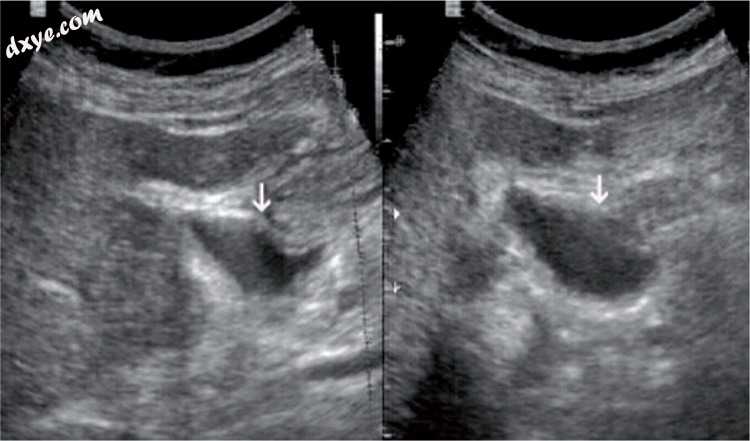
图5
腹腔镜胆囊切除术后。 在两个视图中,十二指肠球部的液体占据了移除的胆囊的位置,类似病理集合(箭头)
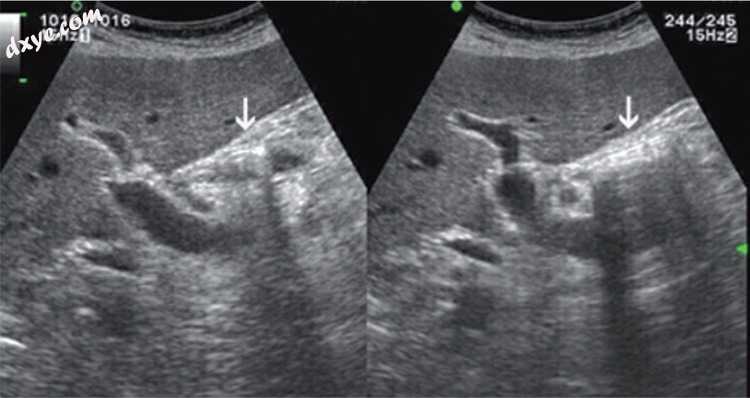
图6
十二指肠球在胆囊床中随时间(箭头)改变其含量

图7
腹腔镜胆囊切除术后保留了4厘米长的胆囊碎片
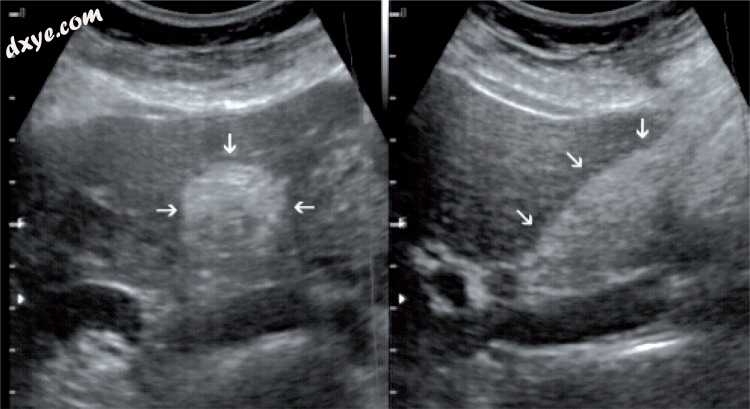
图8
胆囊床被高回声组织占据,厚12毫米(箭头)。 去除胆囊标本后的组织学检查显示细胞异型性的特征
LCH的并发症
腹腔镜胆囊切除术后并发症的发生频率低于常规剖腹手术后的并发症(2-4)。 它们通常可分为:
胆囊和胆管损伤;
血管损伤;
肝脏和其他器官受伤;
腹壁受伤。
LCH后胆囊和胆管损伤
从肝脏分离期间胆囊壁撕裂是常见的并发症(LCH的20%),特别是当该区域存在炎症性浸润和粘连时。在8%的病例中,伴有腹膜腔溢出的结石(15,16),这有脓肿形成的风险。当结石被收回时,脓肿发展的风险估计为2.3%,但当结石被保留时,脓肿发展的风险上升至7%(16)(图9)。应该在胆囊床,右肝叶下或Morison囊中寻找掉落的结石(图10-12)。有时,它们可能在肚脐区域被检测到。然而,应该记住,可以在腹膜腔的每个区域或多个位置发现这种结石。其识别中的选择方法是计算机断层扫描(17)。移除胆囊相关的困难也可能导致胆囊管或甚至胆囊的近端部分(可能含有结石)(图13)。即使胆囊的保留片段中没有结石,这种情况也会有利于它们的形成和持续的炎症。找到保留的胆囊碎片的最有效方法是MRCP(17,18)。

图9
腹腔镜胆囊切除术后三个月。 在两种观点中,在肝脏下可以看到具有轻微胆汁结石(箭头)的脓肿
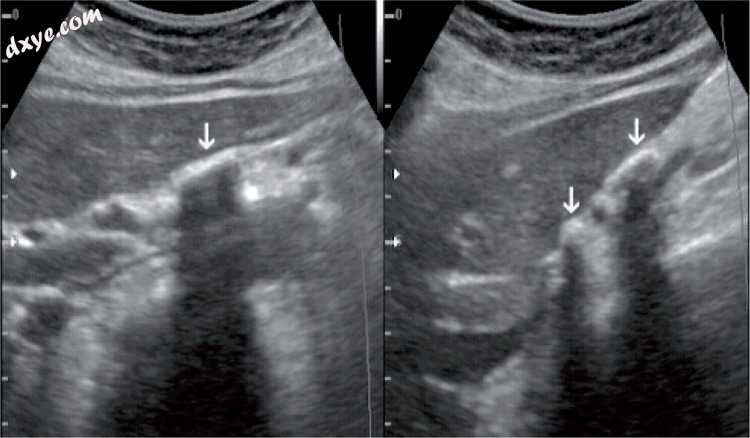
图10
在胆囊床中可以看到几个胆汁结石(箭头)
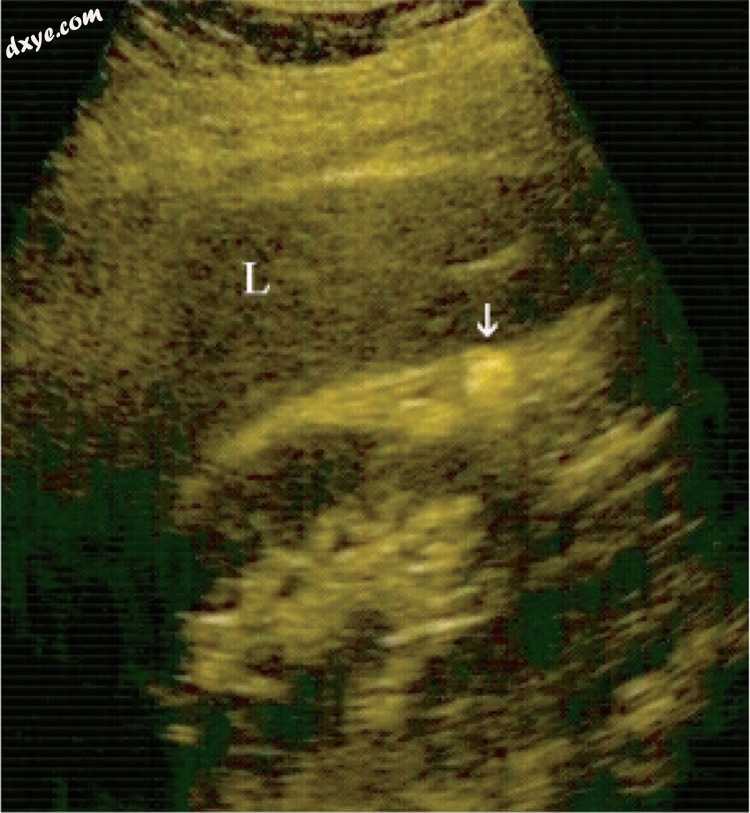
图12
腹腔镜胆囊切除术后五年。 在肝肾凹陷中可见单个胆汁结石(箭头)。 L - 肝脏
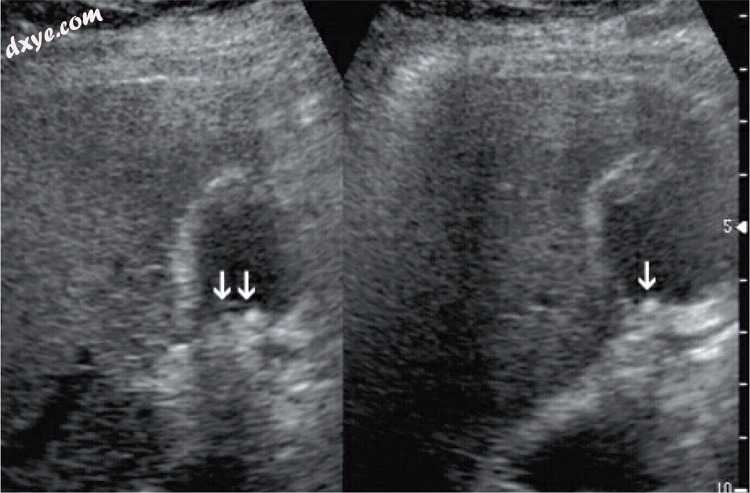
图13
胆囊残端综合征。 腹腔镜胆囊切除术后保留的胆囊碎片中可见轻微胆汁结石(箭头)

图11
腹腔镜胆囊切除术后7天。在肝脏(L)下,有几种胆汁结石浸没在液体中(箭头)
胆管损伤是腹腔镜手术相对常见的并发症。他们的频率估计为0.6-4%(12,18-20)。一方面,它们可能来自:切割,切断,燃烧或用夹子夹住胆总管或肝脏胆管,通常是右胆管(4,13)(图14)。另一方面,它们可能是由胆囊管或滑动手术夹(20,21)的不充分闭合引起的(图15),然而,这很少导致胆管(22)中结石的形成。在LCH后确定的胆管中存在结石可能是由于在手术前未能检测到它们,或者当胆囊与肝脏分离时它们移动到胆总管。它们在外科手术后在肝内胆管中的形成是一种现象。因此,某些操作者建议进行术中胆管造影,以便在移除胆囊之前解释解剖学情况并避免LCH的不良影响。然而,其他人反对这种方法的常规应用(15,23-26)或提出腹腔镜超声检查(26,27)。可以通过各种方法鉴定可以在LCH后发展的胆汁(胆汁瘤)的集合。在这种情况下,超声波检查显示液体收集,当胆汁泄漏活跃时,液体收集会扩大(图16)。黄金标准是内窥镜逆行胰胆管造影术,因为它允许指定胆漏的部位,并且能够在治疗这种并发症时进行熟悉的支架术(6,8,9,11,12,19,20,28)。此外,胆漏的部位和内容的特征也可以通过以下方式识别:肝脏x闪烁显像,经皮肝穿刺胆管造影和MRCP。 CT胆管造影术的使用较少(11,12,23)。 LCH后胆管瘤的发病率估计为0.2-2%(29)。这通常是胆囊管无效闭合,肝脏损伤或无法识别辅助胆管,即所谓的Luschka导管或胆囊下胆管(29,30)的结果。在解剖学检查中,在3%的人和成像检查中检测到该导管 - 占4%的人。很难检测,因为它的宽度很小(平均2毫米)。它主要局限于右肝叶,邻近并平行于胆囊窝行进,因此在胆囊切除期间易受损伤。可以使用静脉内胆管造影术,内窥镜逆行胰胆管造影术或MRCP对其进行可视化。偶尔,它可以在超声检查中可视化,通常在胆道高血压患者中(图17)。在LCH后第一周,Luschka导管受伤导致胆漏。
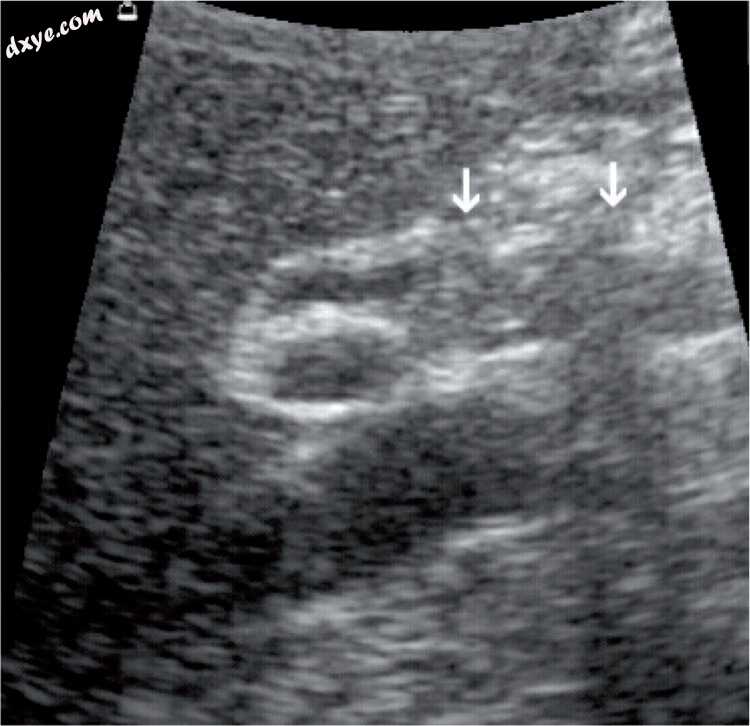
图14
胆管损伤。 腹腔镜胆囊切除术中胆总管受损。 经过两次修复手术后,瘢痕组织在肝十二指肠韧带中增生(箭头)
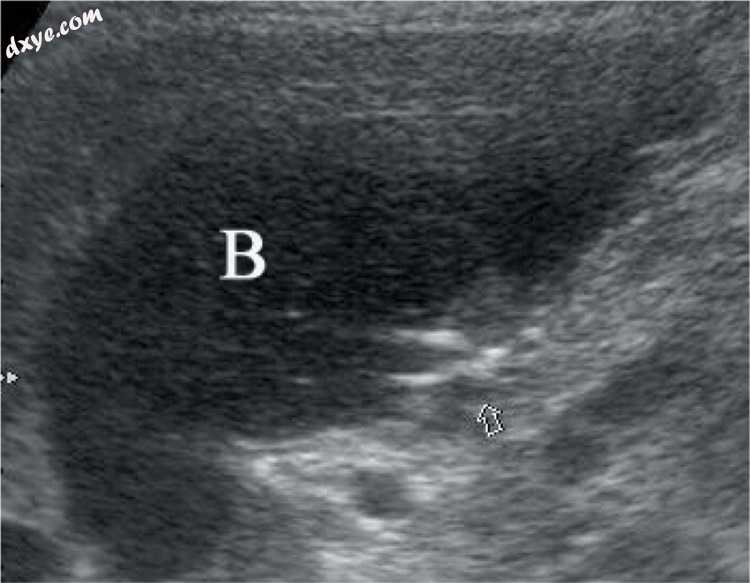
图15
腹腔镜胆囊切除术后两天。 在肝脏下方的胆管收集(B)的底部,可以看到从胆囊管滑落的手术金属夹

图16
腹腔镜胆囊切除术后广泛的胆汁瘤(B)部分压迫肝脏
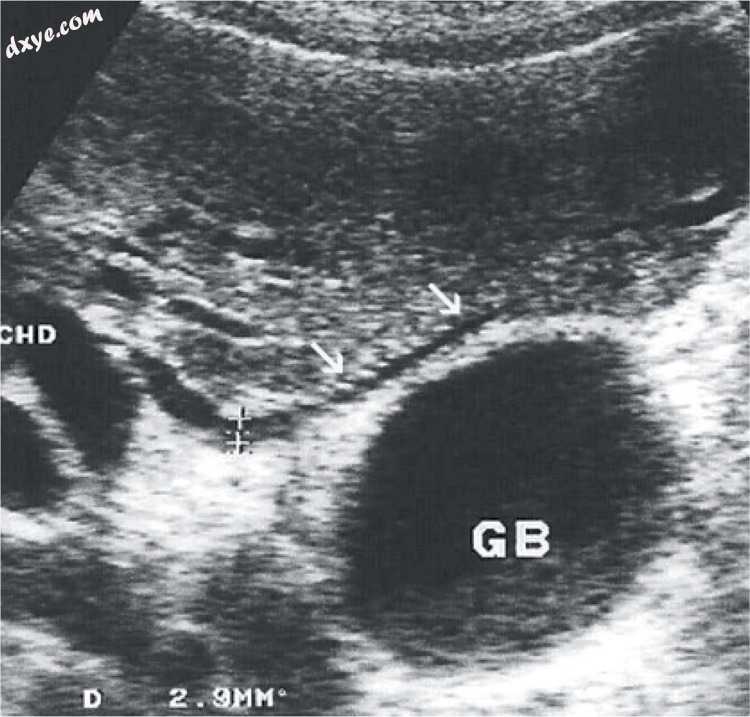
图17
Luschka的管道宽度为2毫米(箭头)平行于胆囊窝。 GB - 胆囊,CHD - 肝总管。患有胆汁淤积的患者由胰头癌引起
LCH后的血管损伤
它们是LCH期间机械或热活动的结果。这种类型的损伤涉及LCH的4.1%,术中发现2.3%,术后发现1.8%(31)。出血通常是由于胆囊动脉的不紧密闭合或右肝动脉的切口而发生的。在这种情况下,与失血和低CBC参数相关的症状构成了紧急干预的指示。 CT血管造影和腹腔造影或肠系膜造影证明可用于确定损伤部位。更重要的是,最后两种方法还有助于血管内出血治疗(8,31)。超声检查可以确认流体收集的存在,其回声和大小随时间而变化(11)。但是,超声的检查无法将其与胆汁或脓肿的集合区分开来。超声检查可用于区分LCH的其他血管并发症,例如假性动脉瘤或门静脉血栓形成。它允许预测胆囊窝通过宽静脉(通常是肝中静脉)排出胆囊床时出血的风险(32)(图18)。严重并发症包括对大血管的损伤,例如肠系膜上静脉,腔静脉或主动脉(33-35)。此外,供应肝脏或门静脉阻塞的动脉闭合可能导致不同程度的肝脏坏死,有时需要切除手术,有时甚至需要肝脏移植(33)。值得补充的是,肝血管损伤经常与胆管损伤(血管胆管损伤)共存,这在很大程度上恶化了预后。在Strasberg和Helton(34)的材料中,LCH后18%的患者出现了这种并发症。

图18
宽中间肝静脉排出胆囊窝。 GB - 胆囊
LCH期间其他器官受伤
这是一种罕见的并发症。单一报告显示由于粗心手术导致的脾,肠和膈肌早期和延迟损伤的病例(8)。
破坏腹壁的解剖学完整性
这种类型的并发症构成了LCH手术的一部分,并带有端口疝的风险。它发生在0.02-3.6%的手术后,有时可能引起小肠梗阻(36,37)。作者的经验表明,在这种情况下,超声检查在计算机断层扫描的诊断过程中同样有用(图19)。与套管针插入相关的另一种罕见并发症是腹壁血肿。它的发展主要是由于上腹动脉分支或动脉本身的损伤(34)(图20)。超声检查有助于在手术前指定端口部位,以便腹腔镜器械能够非碰撞地插入腹膜腔,从而防止腹壁血管受损,并有助于避免腹膜粘连(38) )。
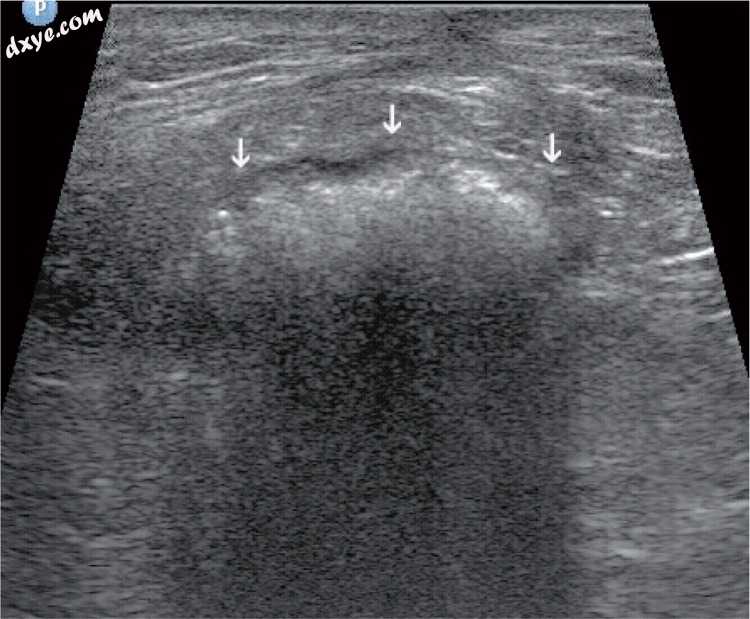
图19
腹腔镜胆囊切除术后腹壁疝。 疝囊中的小肠与气体(箭头)的环

图20
继发于腹腔镜胆囊切除术的腹部皮层(H)中的血肿
结论
LCH后的超声检查主要用于诊断:胆囊床和肝脏周围的病理性液体收集,胆汁淤积,假性动脉瘤,门静脉血栓形成以及腹壁中的血肿和疝气。此外,这种方法可用于搜索右侧下区域中的落石和保留胆囊的可能结石以及未确诊的胆总管结石。此外,超声波能够实现引导穿刺以用于诊断和治疗目的。超声检查还允许规定腹腔镜器械的最佳位置。然而,应该得出结论,除了腹壁病变外,与LCH相关的所有不良反应最好通过内镜超声检查来诊断,就像在微胆管结石的诊断中一样(39,40)。
参考:
Role of sonography in assessing complications after laparoscopic cholecystectomy
1. Ćwik G, Wallner G, Ciechański A, Paździor M. Ostre zapalenie pęcherzyka żółciowego – kwalifikacja do cholecystektomii w ocenie USG. Pol Przegl Chir. 2000;72:351–362. [Google Scholar]
2. Brandon JC, Velez MA, Teplick SK, Mueller PR, Rattner DW, Broadwater JR, Jr, et al. Laparoscopic cholecystectomy: evolution, early results, and impact on nonsurgical gallstone therapies. AJR Am J Roentgenol. 1991;157:235–239. [PubMed] [Google Scholar]
3. Lujan JA, Parrilla P, Robles R, Marin P, Torralba JA, Garcia-Ayllon J. Laparoscopic cholecystectomy vs open cholecystectomy in the treatment of acute cholecystitis: a prospective study. Arch Surg. 1998;133:173–175. [PubMed] [Google Scholar]
4. Kang EH, Middleton WD, Balfe DM, Soper NJ. Laparoscopic cholecystectomy: evaluation with sonography. Radiology. 1991;181:439–442. [PubMed] [Google Scholar]
5. Bersani D, Lallemand M. Aspect échographique des collections liquidiennes de la loge vésiculaire après cholécystectomie: à propos de 11 observations. J Radiol. 1986;67:589–593. [PubMed] [Google Scholar]
6. McAlister VC. Abdominal fluid collection after laparoscopic cholecystectomy. Br J Surg. 2000;87:1126–1127. [PubMed] [Google Scholar]
7. Müller S, Falch C, Kreuzer J, Storz P, Konigsrainer A, Kirschniak A. Utility of routine ultrasound after laparoscopic cholecystectomy to detect early postoperative complication. Dig Surg. 2012;29:183–186. [PubMed] [Google Scholar]
8. Thurley PD, Dhingsa R. Laparoscopic cholecystectomy: postoperative imaging. AJR Am J Roentgenol. 2008;191:794–801. [PubMed] [Google Scholar]
9. Smith R, Kolyn D, Pymar H, Sauerbrei E, Pace RF. Ultrasonographic and radiologic evaluation of patients after laparoscopic cholecystectomy. Can J Surg. 1992;35:55–58. [PubMed] [Google Scholar]
10. Schnarkowski P, Decker D, Decker P, Kreft B, Hirner A, Reiser MF. [Radiological diagnosis before and after laparoscopic cholecystectomies] Rofo. 1995;162:497–501. [PubMed] [Google Scholar]
11. Ray CE, Jr, Hibbeln JF, Wilbur AC. Complications after laparoscopic cholecystectomy: imaging findings. AJR Am J Roentgenol. 1993;160:1029–1032. [PubMed] [Google Scholar]
12. Kozarek R, Gannan R, Baerg R, Wagonfeld J, Ball T. Bile leak after laparoscopic cholecystectomy. Diagnostic and therapeutic application of endoscopic retrograde cholangiopancreatography. Arch Intern Med. 1992;152:1040–1043. [PubMed] [Google Scholar]
13. Keiler A, Pernegger C, Hornof R, Wenzl S, Brandtner W. Der Zystikusstumpf nach Cholezystektomie. Wien Klin Wochenschr. 1992;104:356–359. [PubMed] [Google Scholar]
14. Lin EC, Alavi A. PET and PET/CT: A Clinical Guide; Stuttgart, New York: Georg Thieme Verlag; 2006. [Google Scholar]
15. Brockmann JG, Kocher T, Senninger NJ, Schurmann GM. Complications due to gallstones lost during laparoscopic cholecystectomy. Surg Endosc. 2002;16:1226–1232. [PubMed] [Google Scholar]
16. Woodfield JC, Rodgers M, Windsor JA. Peritoneal gallstones following laparoscopic cholecystectomy: incidence, complications, and management. Surg Endosc. 2004;18:1200–1207. [PubMed] [Google Scholar]
17. Smereczyński A, Starzyńska T, Gałdyńska M, Walecka A, Bojko S, Kładna K, et al. Kamienie żółciowe w jamie otrzewnowej po cholecystektomii – diagnostyka ultrasonograficzna. Ultrasonografia. 2008;8(34):61–65. [Google Scholar]
18. Park MS, Yu JS, Kim YH, Kim MJ, Kim JH, Lee S, et al. Acute cholecystitis: comparison of MR cholangiography and US. Radiology. 1998;209:781–785. [PubMed] [Google Scholar]
19. Richardson MC, Bell G, Fullarton GM. Incidence and nature of bile duct injuries following laparoscopic cholecystectomy: an audit of 5913 cases. West of Scotland Laparoscopic Cholecystectomy Audit Group. Br J Surg. 1996;83:1356–1360. [PubMed] [Google Scholar]
20. Adamsen S, Hansen OH, Funch-Jensen P, Schulze S, Stage JG, Wara P. Bile duct injury during laparoscopic cholecystectomy: a prospective nationwide series. J Am Coll Surg. 1997;184:571–578. [PubMed] [Google Scholar]
21. Gonzalez FJ, Dominguez E, Lede A, Jose P, Miguel P. Migration of vessel clip into the common bile duct and late formation of choledocholithiasis after laparoscopic cholecystectomy. Am J Surg. 2011;202:e41–e43. [PubMed] [Google Scholar]
22. Herline AJ, Fisk JM, Debelak JP, Shull HJ, Jr, Chapman WC. Surgical clips: a cause of late recurrent gallstones. Am Surg. 1998;64:845–848. [PubMed] [Google Scholar]
23. Törnqvist B, Strömberg C, Persson G, Nilsson M. Effect of intended intraoperative cholangiography and early detection of bile duct injury on survival after cholecystectomy: population based cohort study. BMJ. 2012;345:e6457. [PMC free article] [PubMed] [Google Scholar]
24. Sato N, Shibao K, Akiyama Y, Inoue Y, Mori Y, Minagawa N, et al. Routine intraoperative cholangiography during single-incision laparoscopic cholecystectomy: a review of 196 consecutive patients. J Gastrointest Surg. 2013;17:668–674. [PubMed] [Google Scholar]
25. Ford JA, Soop M, Du J, Loveday BP, Rodgers M. Systematic review of intraoperative cholangiography in cholecystectomy. Br J Surg. 2012;99:160–167. [PubMed] [Google Scholar]
26. Machi J, Oishi AJ, Uchida S, Furumoto NL, Oishi RH. Simple laparoscopic ultrasound technique for prevention of bile duct injuries. J Laparoendosc Adv Surg Tech A. 2000;10:165–168. [PubMed] [Google Scholar]
27. Nasu M, Yoshimura S, Uomori T, Takehara K, Tanaka R, Miyano S, et al. The efficacy of intraoperative ultrasonography during laparoscopic. Hepatogastroenterology. 2012;59:1003–1005. [PubMed] [Google Scholar]
28. Kim JY, Kim KW, Ahn CS, Hwang S, Lee YJ, Shin YM, et al. Spectrum of biliary and nonbiliary complications after laparoscopic cholecystectomy: radiologic findings. AJR Am J Roentgenol. 2008;191:783–789. [PubMed] [Google Scholar]
29. Spanos CP, Syrakos T. Bile leaks from the duct of Luschka (subvesical duct): a review. Langenbecks Arch Surg. 2006;391:441–447. [PubMed] [Google Scholar]
30. Schnelldorfer T, Sarr MG, Adams DB. What is the duct of Luschka? A systematic review. J Gastrointest Surg. 2012;16:656–662. [PubMed] [Google Scholar]
31. Schäfer M, Lauper M, Krähenbühl L. A nation's experience of bleeding complications during laparoscopy. Am J Surg. 2000;180:73–77. [PubMed] [Google Scholar]
32. Smereczyński A. Ocena sonograficzna drenażu żylnego dołu pęcherzyka żółciowego. Pol Przegl Radiol. 1995;60:217–220. [Google Scholar]
33. Keleman AM, Imagawa DK, Findeiss L, Hanna MH, Tan VH, Katz MH, et al. Associated vascular injury in patients with bile duct injury during cholecystectomy. Am Surg. 2011;77:1330–1333. [PubMed] [Google Scholar]
34. Strasberg SM, Helton WS. An analytical review of vasculobiliary injury in laparoscopic and open cholecystectomy. HPB (Oxford) 2001;13:1–14. [PMC free article] [PubMed] [Google Scholar]
35. Madanur MA, Battula N, Sethi H, Deshpande R, Heaton N, Rela M. Pseudoaneurysm following laparoscopic cholecystectomy. Hepatobiliary Pancreat Dis Int. 2007;6:294–298. [PubMed] [Google Scholar]
36. Bemporad JA, Zreik TG, Brink JA. Laparoscopic hernias: two case reports and a review of the literature. J Comput Assist Tomogr. 1999;23:86–89. [PubMed] [Google Scholar]
37. Wicks A, Voyvodic F, Scroop R. Incisional hernia and small bowel obstruction following laparoscopic surgery: computed tomography diagnosis. Australas Radiol. 2000;44:331–332. [PubMed] [Google Scholar]
38. Caprini JA, Arcelus JA, Swanson J, Coats R, Hoffman K, Brosnan JJ, et al. The ultrasonic localization of abdominal wall adhesions. Surg Endosc. 1995;9:283–285. [PubMed] [Google Scholar]
39. Thorbøll J, Vilmann P, Jacobsen B, Hassan H. Endoscopic ultrasonography in detection of cholelithiasis in patients with biliary pain and negative transabdominal ultrasonography. Scand J Gastroenterol. 2004;39:267–269. [PubMed] [Google Scholar]
40. Ney MV, Maluf-Filho F, Sakai P, Zilberstein B, Gama-Rodrigues J, Rosa H. Echo-endoscopy versus endoscopic retrograde cholangiography for the diagnosis of choledocholithiasis: the influence of the size of the stone and diameter of the common bile duct. Arq Gastroenterol. 2005;42:239–243. [PubMed] [Google Scholar] |


