马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
概要
背景
TKA术后的软组织缺损是一种潜在的破坏性并发症。偶尔使用内侧腓肠肌皮瓣来提供软组织覆盖,最常见的是假体周围关节感染。
问题/目的
作者问:(1)TKA术后接受内侧腓肠肌皮瓣修复软组织覆盖的患者持续或复发感染,植入生存,皮瓣相关并发症和再次手术的比率是多少? (2)对于TKA术后软组织缺损的内侧腓肠肌瓣重建患者,膝关节协会的临床和功能评分是多少? (3)TKA术后内侧腓肠肌瓣重建失败的危险因素是什么,失败定义为复发或新的假体周围关节感染或无法重新植入TKA假体?
方法
在2003年至2011年期间,一家机构的四名外科医生在感染的TKA上进行了31次内侧腓肠肌皮瓣的软组织覆盖。其中,27例(87%)可用于至少2年的随访(平均4年;范围2-6岁),但包括两年前出现并发症或治疗失败的患者。该研究组由15名男性和12名女性组成,手术时平均年龄为61岁(范围36-86岁)。在这种情况下使用腓肠肌皮瓣的一般适应症是在伴随深部感染的治疗过程中在前膝上的全层软组织缺陷。在假体移植和抗生素间隔物放置时进行六个皮瓣,在间隔物交换处进行八次皮瓣,在第二阶段TKA假体再植入时进行八次皮瓣,并且在进行聚乙烯交换的情况下进行五次皮瓣修复。关于何时在分期治疗期间放置皮瓣的决定仅基于何时认为软组织不足,而不是基于相信在一个阶段与另一个阶段的放置是有利的信念。失败被定义为无法再植入TKA假体或复发假体周围关节感染。测试患者和程序特征与失败的关联。通过Cox比例风险模型计算生存率。结果分数来自纵向机构登记处。
结果
27名(52%)患者中有14名患有持续性或复发性感染; 4年时TKA假体的存活率为48%(95%CI,31%-66%)。虽然没有与皮瓣相关的并发症,但在研究期间,12名患者共进行了19次再次手术。总体而言,在最近的随访中,平均(±SD)膝关节膝关节(38±18 vs 65±20; p <0.001)和功能(20±22 vs 37±25; p = 0.002)评分得到改善。当应用Bonferroni校正时,没有发现与失败相关的因素。
结论
在存在深部感染的情况下,腓肠肌皮瓣用于解决该系列中困难的软组织缺损;经历持续性或复发性感染的患者的高比例反映了病例复杂性并且不一定是皮瓣的问题。然而,该系列强调了继续探索管理这一棘手临床问题的替代方法的必要性。未来的研究应该旨在建立一个基于证据的重建算法,重点关注可能最大化结果的宿主,伤口和时间特征。
证据水平
IV级,治疗研究。
介绍
TKA术后多达20%的患者可能出现创伤并发症[1]。加拉特等人。 [7]发现接受TKA治疗的患者中有0.33%会出现需要手术治疗的伤口并发症,但与没有伤口并发症的患者相比,接受TKA治疗的患者接受重大手术治疗的可能性要高5倍。特别是,术后发生严重皮肤坏死和下方硬件暴露的伤口大大增加了发生深度假体周围感染的风险,可能引发灾难性的级联,导致假体丢失和关节固定或肢体截肢[5, 16]。
虽然已经开发了几种技术来提供暴露假体的覆盖,但内侧腓肠肌皮瓣仍然是软组织重建的首选方法[8,28]。这种轴向纹的翼片由于其相当大的尺寸和移动性而特别通用。它为覆盖的皮肤移植物提供了一个血管床,有助于改善氧气,全身性抗生素和免疫调节剂向受感染关节的输送[8,25]。尽管一些作者报道了TKA后内侧腓肠肌皮瓣覆盖后的有利结果,假体保留率高达82%至92%[8,23,28],据作者所知,最大的英语系列仅包括22例内侧腓肠肌皮瓣[6]。随着越来越多的患者接受TKA [14],假体周围关节感染的病例数也在增加。更好地了解内侧腓肠肌皮瓣覆盖后的结果,包括治疗失败的风险因素,将有助于指导这种情况下软组织缺陷的管理。
因此,作者回顾了作者对内侧腓肠肌皮瓣的经验,以回答以下问题:(1)TKA后接受内侧腓肠肌皮瓣重建的患者持续或复发感染率,植入物存活率,皮瓣相关并发症和再次手术的比率是多少? (2)对于TKA术后软组织缺损的内侧腓肠肌瓣重建患者,膝关节协会的临床和功能评分是多少? (3)TKA术后内侧腓肠肌瓣重建失败的危险因素是什么,失败定义为复发或新的假体周围关节感染或无法重新植入TKA假体?
方法
在2003年至2011年期间,一家医院的四名外科医生(RWW,JJF,GHD,SRS)在感染的TKA上进行了31次内侧腓肠肌皮瓣的软组织覆盖。其中,27例(87%)患者可以随访至少2年(平均4年;范围2-6岁),尽管患者在2年前出现并发症或治疗失败。该研究组由15名男性和12名女性组成,手术时平均年龄为61岁(范围36-86岁)。在此期间,在这种情况下使用腓肠肌皮瓣的一般适应症是前膝盖上的软组织不足。更具体地,在部分厚度的皮肤破裂的情况下,通过二次意图的愈合是有利的,其中预期在10至14天内再上皮化。在没有感染深层组织(例如可形成肉芽组织的肌肉或筋膜)的情况下,对全厚度缺陷进行负压真空辅助闭合,然后进行皮肤移植。当全厚度缺损暴露于肌腱,骨骼或植入物时,或当全厚度手术切口无法在适当的张力下闭合时,皮瓣覆盖是有利的,通常在排出窦被清除后的感染环境中。腓肠肌皮瓣最适用于髌骨下极或远端的开放缺陷。靠近该区域的伤口通常在腓肠肌的范围之外,并且可能需要大腿覆盖(股薄肌或缝匠肌皮瓣,穿孔软组织皮瓣)或游离皮瓣。原发性TKA采用两种手术,25例采用TKA修复(先前膝关节手术的平均数,4种;范围1-11)。四名被排除的患者包括两次在假体再植入后失访(3个月和9个月没有已知的并发症),两个在2年前死亡(一个在尝试假体再植入之前和一个在翻修TKA后一个月)。
所有患者均符合肌肉骨骼感染协会的假体周围关节感染标准[26],最常见的感染生物为葡萄球菌(表1); 8名患者有多种微生物感染,4名患者为培养阴性。
表格1
患者人群概述
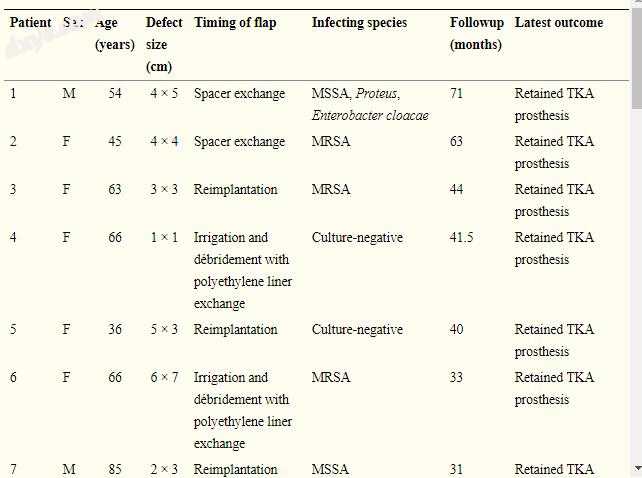
在假体移植和抗生素间隔物放置时进行六个皮瓣,在间隔物交换时进行八次,在第二阶段再植入时进行八次,并且在用模块化聚乙烯衬垫交换进行清创时进行五次。将皮瓣置于某一阶段与另一阶段的决定完全取决于何时认为软组织不足,没有任何偏见或相信一个阶段优于另一个阶段。例如,在移植感染时具有大的开放性伤口或引流窦的患者通常具有当时不能闭合的软组织,因此同时进行皮瓣。没有引流或开放性伤口的深部感染通常能够在移植时关闭,但是如果从新的关节成形植入物增加体积,或者在过度紧张以抵抗膝关节屈曲失败的前部软组织,则可能需要在再植入时翻瓣。皮瓣覆盖程序由主治整形外科医生(GHD,SRS)(8例)或由显微外科研究员培训的骨科手外科医生(RWW,JJF)(19例)进行。确定内侧血管蒂,并释放内侧腓肠肌头并通过皮下隧道向前穿过。将皮瓣缝合到周围的软组织上,并使用从大腿外侧收获的分层皮肤移植物进行初次闭合。注意尽量减少伤口边缘的张力。平均缺陷尺寸为20cm 2(范围,1-84cm 2)。一名患者与跟腱自体移植术同时进行了髌腱重建术。
在所有患者中给予静脉内抗生素至少6周,但进行第二阶段再植入的患者。对于切除关节成形术的患者,在尝试再植入之前,抗生素治疗之后至少需要2周无抗生素间隔。如果使用关节间隔器或假体被保留,则将膝关节固定2至3周以保护皮瓣。皮瓣的护理包括枕垫敷料,膝盖延长1周,然后在皮肤移植物上进行常规的湿到干敷料更换,并在移植物成熟时过渡到保湿剂,通常在4周内。假设静脉间隔物未到位,一旦皮瓣和皮肤移植物显示出良好的存活率,ROM通常在2至3周开始。 22例(82%)接受同期切除关节成形术的患者中有18例最终尝试再植入。
术后,所有患者均定期进行临床评估。如前所述,数据是在最近的后续或失败时呈现的。结果分数来自纵向机构登记处。由独立观察员(临床护士,居民和研究员)测量的临床结果填充了登记处。
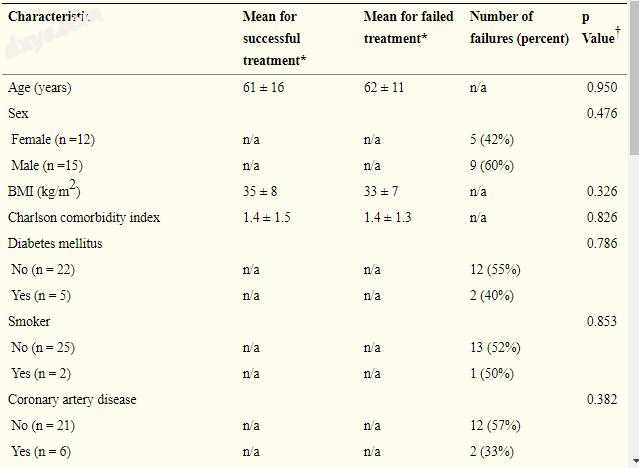
并发症的潜在危险因素,包括年龄,性别,BMI,Charlson合并症指数[4],糖尿病,吸烟状况,冠状动脉疾病,既往膝关节切除术数,先前伸肌机制中断,既往完成两期翻修,皮肤缺损面积,手术服务执行皮瓣(整形手术与整形外科),皮瓣重建时的膝关节手术,接受切除术TKA的患者使用的间隔物类型(关节与静态),以及感染生物的身份和抗生素抗性,记录了。如果患者经历持续性或复发性假体周围关节感染[26]和/或最终进行再次手术,包括切除假体组件,关节固定术或截肢,则将患者归类为治疗失败。保留假体而没有复发感染证据的个体被归类为成功结果。
统计分析
描述性分析包括离散数据和均值的频率和百分比以及连续数据的SD。配对学生的T检验用于比较术前和术后的临床评分,而不成对的T检验用于比较组间的评分。使用Cox比例风险模型测试患者和程序特征与失败的关联。样本量不足导致多变量分析被排除。显著性水平设定为p小于0.05。然而,因为测试了与失败相关的19个个体患者和程序特征,对于这些测试,Bonferroni校正需要将显著性水平降低至小于0.004。
结果
27名(52%)患者中有14名患有持续性或复发性感染;这发生在平均13个月(范围,0.5-72个月)。指数TKA假体在4年时的存活率为48%(95%CI,31%-66%)。没有皮瓣或供体部位并发症。在感染指数治疗后的研究期间,12名患者共进行了19次再次手术。所有再次手术都发生在持续或反复感染的组中;其中包括:6例膝关节固定术,其中一例股骨远端置换术后关节固定失败,1例膝关节截肢,1例胫骨假体翻修,5例采用聚乙烯交换进行灌洗和清创术,4例采用抗生素垫片置入TKA假体,其中1例随后再植假体。两名患者接受慢性口服抗生素抑制,重复假体周围关节感染并保留植入物;这些患者被认为有治疗失败。两名患者在麻醉下也进行了膝关节僵硬操作。
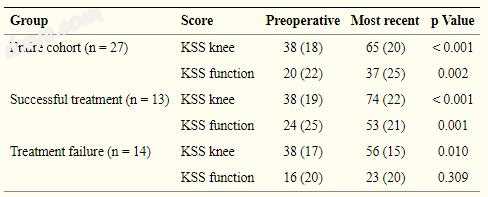
对于整个队列,平均膝关节协会(KSS)膝关节和功能评分[12]得到改善(表2)。在最近的随访中,术前KSS膝关节评分(平均值±SD)从38±18增加到65±20(p <0.001),KSS函数从20±22增加到37±25(p = 0.002)。最终的KSS膝关节评分在8名患者(31%)中被评为优秀(评分为80至100),良好(70至79)在4名(15%),公平(60至69),3名(12%), 11例(42%)[2](不包括膝关节截肢的患者,因为评分是基于关于膝关节的客观参数)。接受成功皮瓣治疗的患者在KSS评分的两个组成部分中经历了更大的增加(表2)。虽然治疗失败的患者平均得分也有所增加,但KSS膝关节平均得分低于60分,功能评分极差。
表2
TKA术后内侧腓肠肌皮瓣的临床结果评分
有了这些数据,治疗失败与年龄,性别,BMI,Charlson合并症指数,糖尿病,吸烟状况,冠状动脉疾病,皮瓣覆盖前膝关节切除术的数量,伸肌机制破裂,先前完成的两阶段修正,皮瓣缺损区域,进行皮瓣的手术服务,皮瓣时进行膝关节手术,间隔型(如果皮瓣是两阶段交换的一部分),或金黄色葡萄球菌,肠球菌,革兰氏阴性杆的生长,或抗生素抗性细菌(每个p> 0.004;表3)。与灌注和清创或再植假体时相比,当抗生素间隔物放置或交换同时进行皮瓣覆盖时,存在失败的趋势,但这没有达到统计学显著性(71%对31%; p = 0.033)。特别是,治疗失败率是灌溉和清创术的五分之一(20%),再植入八分之三(38%),间隔交换八分之五(63%),六分之五(83%)移出。
表3
患者和手术特征与内侧腓肠肌瓣成功与失败的关系(双变量分析)
讨论
TKA术后伤口并发症可能会造成破坏性后果。以前的研究报道,在使用内侧腓肠肌皮瓣进行软组织覆盖后,假体保留率很高,假体周围感染率相当低[8,23,24,28]。然而,这些研究中的大多数都很小,并没有评估失败的风险因素。作者认为,在TKA术后围手术期关节感染中接受内侧腓肠肌皮瓣治疗的最大系列患者,作者评估了(1)持续性或复发性感染率,植入物存活率,皮瓣相关并发症和再次手术,( 2)临床结果,和(3)使用皮瓣时持续或复发感染的危险因素。
本研究在解释结果时应考虑一些限制因素。首先,作者的调查是回顾性的,因此受到选择偏差和缺乏统一性的影响,包括程序的不同时间。在研究期间,作者通常坚持上述的软组织覆盖的一致适应症和治疗算法,并希望有限的选择偏倚。然而,作者的研究队列(主要包括多次手术和慢性感染的患者,被转诊到作者的三级转诊中心)可能在感染过程中早期受益于皮瓣覆盖(例如,适度的伤口引流)比暴露的植入物)。虽然在修订设置的复杂病例中固有变异性,但是由一组由四名显微外科培训的主治外科医生(RWW,JJF,GHD,SRS)组成的所有皮瓣手术的性能有助于最小化手术技术的异质性。其次,作者系列中包括的患者数量可能不足以检测在皮瓣覆盖后预示较差预后的因素。样本量也排除了多变量分析以控制混杂变量。然而,据作者所知,这是TKA后报道的最大的内侧腓肠肌皮瓣系列。虽然作者的风险因素分析没有确定治疗失败的统计学显著预测因素,但它为进一步研究可能对治疗结果产生负面影响的因素提供了基础,例如皮瓣覆盖的时间。第三,作者队列的平均随访时间相对较短,尽管皮瓣的活力通常可以早期确定,并且复发或持续感染的失败通常也是早期已知的。观察到的高失败率表明,用于治疗假体周围感染的腓肠肌皮瓣应被视为抢救程序。虽然有必要进行长期数据和前瞻性临床研究,但这一回顾性系列研究结果可能有助于外科医生确定和建议在TKA术后内侧腓肠肌瓣重建后可能有治疗失败风险的患者。
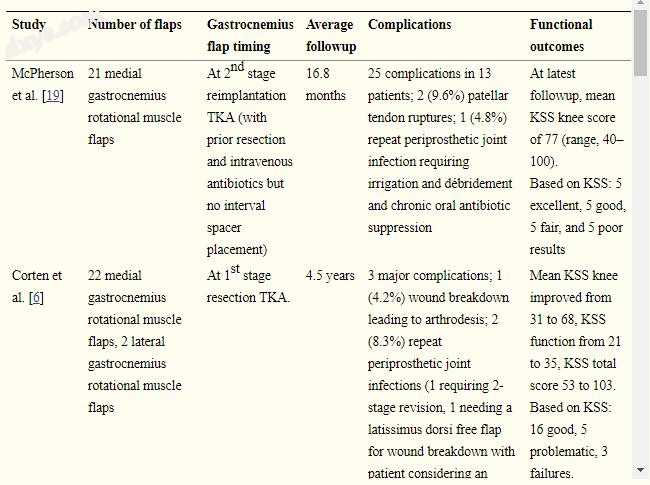
观察到的复发性或持续性假体周围关节感染的高频率和假体保留频率低与两项先前研究的结果相比较,这两项研究检查了感染的TKA的腓肠肌肌瓣重建结果[6,19](表4)。作者的队列中较差的结果可能部分归因于在皮瓣覆盖和/或更大的软组织损失之前更多的膝关节操作。 Corten等人。 [6]报道,42%的皮瓣遵循原发性TKA,而作者的队列只有7%,而McPherson等。 [19]在作者的队列中报告了平均3.4(范围,1-6次手术)之前的膝关节手术,而4(范围,1-11手术),似乎差异较小。同时,两项研究均未报告皮瓣覆盖时软组织丢失的程度;作者研究组的实质性软组织损失(平均缺损面积为20 cm2)导致相对较差的结果,这似乎是合理的。据报道,在几个大型系列[9,21,22,30]中,两阶段交换关节置换术对假体周围感染的成功率在66%至91%之间。作者的研究支持了之前的一些研究[7,22,23],这些研究表明应该告知患者,在存在叠加的软组织损害的情况下,两阶段交换关节成形术对于感染的结果更糟,需要皮瓣重建。对于未来的研究来说,前瞻性地比较类似宿主中类似缺陷的软组织覆盖的替代方式将是有益的。作者怀疑,作者观察到的重复感染率和假体保留率是多次手术并且内侧腓肠肌瓣功能较差的患者大量软组织丢失的结果,尽管作者的研究设计不允许这样的见解。
表4
报告TKA术后软组织缺损腓肠肌瓣重建临床结果的研究综述
作者系列中的结果评分较低(表2)与之前评估TKA皮瓣覆盖后功能参数的研究结果(表4)。所有皮瓣可靠愈合的事实表明,随后的不良功能可能与软组织损害的严重程度和潜在的假体感染有关,而不是皮瓣选择或技术。皮瓣覆盖后膝关节的早期ROM可能有改善的功能结果,然而,报告膝关节最早10天的研究者也报告了更高的伤口并发症发生率[19]。虽然皮瓣的感觉很差,但由于剩余的比目鱼肌和半腓肠肌的补偿,皮瓣的功能丧失和合并症通常很小[11,18]。由于这些原因以及手术可及性和皮瓣的伸展范围,作者继续更喜欢内侧腓肠肌用于翻修TKA的软组织覆盖,用于髌骨下极或远端的全厚度缺损,或者不能进行手术切口。在适当的紧张局势下关作者通常保留大腿覆盖(股薄肌或缝匠肌皮瓣,穿孔软组织皮瓣)或自由皮瓣用于接近该区域的伤口或腓肠肌皮瓣失效时的情况。未来的工作可以探讨皮瓣覆盖前膝盖后固定持续时间的功能影响,以及是否有任何作用扩大大腿覆盖或游离皮瓣的适应症。在顽固性假体周围关节感染和伤口分解的患者的挑战性治疗中,研究是否存在早期考虑关节固定术的功能论证也可能是有价值的[5,11]。
作者无法确定与可用数量的感染TKA的腓肠肌瓣重建失败相关的因素。尽管一些作者[8,19,20,31]提出了基于较小系列的不良预后因素,但据作者所知,作者的研究是第一个在这种情况下统计评估与皮瓣衰竭相关的因素。当在抗生素间隔物放置的同时进行皮瓣覆盖时存在失败的趋势,但是这没有达到统计学显著性。尽管已经报道了在第一阶段切除术TKA [6]和第二阶段再植入[19]时腓肠肌瓣的表现可接受的结果,但作者的研究结果表明,在两阶段交换关节成形术的背景下,延迟皮瓣覆盖直到之后如果在切除或更换间隔物时软组织易于闭合,则可建议治疗感染。或者,似乎合理的是,接受间隔物放置的皮瓣覆盖的患者具有更严重的软组织缺陷,这导致更差的结果。作者研究中的患者通常有多个先前的膝关节手术(平均4个),这可能导致总体继发于血液供应减少和残留瘢痕形成[13],但作者无法将此变量作为独立危险因素治疗失败。作者同样无法证实挽救性肌皮瓣失效的其他潜在风险因素,包括性别,年龄,BMI,感染生物体,抗生素间隔物类型或个体合并症(烟草使用[20,31],反射性生活感神经营养不良综合征[19] ],糖尿病[19,20],慢性肾功能衰竭[20],外周血管疾病[20],类固醇使用[20])。尽管存在这些无差异的发现,但研究可能效果不佳,并且在可能的情况下围手术期建议优化可修改的变量。虽然有些研究认为浅表培养结果是预后不良的危险因素[8,31],但作者建议不要因细菌污染的高风险而对常规微生物擦拭引流伤[25,32]。
在这个大型回顾性系列中,内侧腓肠肌皮瓣用于治疗深部感染治疗期间难以治愈的软组织缺损。经历持续或复发感染的患者比例很高,反映了病例的复杂性,并不一定是皮瓣的问题;这些都是具有挑战性的案例不幸的是,作者无法确定评估与治疗失败相关的众多因素的重要性。然而,这项研究强调需要继续探索管理这一棘手的临床问题的替代方法。未来的工作应该旨在建立一个基于证据的重建算法,重点关注宿主,伤口和时间特征,可以最大化结果或促进替代皮瓣。
参考:
What Factors Influence the Success of Medial Gastrocnemius Flaps in the Treatment of Infected TKAs?
1. Alexiades M, Sands A, Craig S, Scott WN. Management of selected problems in revision knee arthroplasty. Orthop Clin North Am. 1989;20:211–219. [PubMed] [Google Scholar]
2. Asif S, Choon DS. Midterm results of cemented Press Fit Condylar Sigma total knee arthroplasty system. J Orthop Surg (Hong Kong). 2005;13:280–284. [PubMed] [Google Scholar]
3. Casanova D, Hulard O, Zalta R, Bardot J, Magalon G. Management of wounds of exposed or infected knee prostheses. Scand J Plast Reconstr Hand Surg. 2001;35:71–77. doi: 10.1080/02844310151032637. [PubMed] [CrossRef] [Google Scholar]
4. Charlson M, Szatrowski TP, Peterson J, Gold J. Validation of a combined comorbidity index. J Clin Epidemiol. 1994;47:1245–1251. doi: 10.1016/0895-4356(94)90129-5. [PubMed] [CrossRef] [Google Scholar]
5. Conway JD, Mont MA, Bezwada HP. Arthrodesis of the knee. J Bone Joint Surg Am. 2004;86:835–848. [PubMed] [Google Scholar]
6. Corten K, Struelens B, Evans B, Graham E, Bourne RB, MacDonald SJ. Gastrocnemius flap reconstruction of soft-tissue defects following infected total knee replacement. Bone Joint J. 2013;95:1217–1221. doi: 10.1302/0301-620X.95B9.31476. [PubMed] [CrossRef] [Google Scholar]
7. Galat DD, McGovern SC, Larson DR, Harrington JR, Hanssen AD, Clarke HD. Surgical treatment of early wound complications following primary total knee arthroplasty. J Bone Joint Surg Am. 2009;91:48–54. doi: 10.2106/JBJS.G.01371. [PubMed] [CrossRef] [Google Scholar]
8. Gerwin M, Rothaus KO, Windsor RE, Brause BD, Insall JN. Gastrocnemius muscle flap coverage of exposed or infected knee prosthesis. Clin Orthop Relat Res. 1993;286:64–70. [PubMed] [Google Scholar]
9. Goldman RT, Scuderi GR, Insall JN. 2-stage reimplantation for infected total knee replacement. Clin Orthop Relat Res. 1996;331:118–124. doi: 10.1097/00003086-199610000-00016. [PubMed] [CrossRef] [Google Scholar]
10. Greenberg B, LaRossa D, Lotke PA, Murphy JB, Noone RB. Salvage of jeopardized total-knee prosthesis: the role of the gastrocnemius muscle flap. Plast Reconstr Surg. 1989;83(85–89):97–99. doi: 10.1097/00006534-198901000-00018. [PubMed] [CrossRef] [Google Scholar]
11. Harris IE, Leff AR, Gitelis S, Simon MA. Function after amputation, arthrodesis, or arthroplasty for tumors about the knee. J Bone Joint Surg Am. 1990;72:1477–1485. [PubMed] [Google Scholar]
12. Insall JN, Dorr LD, Scott RD, Scott WN. Rationale of the Knee Society clinical rating system. Clin Orthop Relat Res. 1989;248:13–14. [PubMed] [Google Scholar]
13. Jones RE, Russell RD, Huo MH. Wound healing in total joint replacement. Bone Joint J. 2013;95(11 suppl A):144–147. doi: 10.1302/0301-620X.95B11.32836. [PubMed] [CrossRef] [Google Scholar]
14. Kurtz S, Ong K, Lau E, Mowat F, Halpern M. Projections of primary and revision hip and knee arthroplasty in the United States from 2005 to 2030. J Bone Joint Surg Am. 2007;89:780–785. doi: 10.2106/JBJS.F.00222. [PubMed] [CrossRef] [Google Scholar]
15. Lian G, Cracchiolo A, 3rd, Lesavoy M. Treatment of major wound necrosis following total knee arthroplasty. J Arthroplasty. 1989;4(suppl):S23–32. doi: 10.1016/S0883-5403(89)80004-X. [PubMed] [CrossRef] [Google Scholar]
16. Lidwell OM, Lowbury EJ, Whyte W, Blowers R, Stanley SJ, Lowe D. Infection and sepsis after operations for total hip or knee-joint replacement: influence of ultraclean air, prophylactic antibiotics and other factors. J Hyg (Lond). 1984;93:505–529. doi: 10.1017/S0022172400065098. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
17. Markovich GD, Dorr LD, Klein NE, McPherson EJ, Vince KG. Muscle flaps in total knee arthroplasty. Clin Orthop Relat Res. 1995;321:122–130. [PubMed] [Google Scholar]
18. McCraw JB, Fishman JH, Sharzer LA. The versatile gastrocnemius myocutaneous flap. Plast Reconstr Surg. 1978;62:15–23. doi: 10.1097/00006534-197807000-00002. [PubMed] [CrossRef] [Google Scholar]
19. McPherson EJ, Patzakis MJ, Gross JE, Holtom PD, Song M, Dorr LD. Infected total knee arthroplasty: two stage reimplantation with a gastrocnemius rotational flap. Clin Orthop Relat Res. 1997;341:73–81. doi: 10.1097/00003086-199708000-00013. [PubMed] [CrossRef] [Google Scholar]
20. Menderes A, Demirdover C, Yilmaz M, Vayvada H, Barutcu A. Reconstruction of soft tissue defects following total knee arthroplasty. Knee. 2002;9:215–219. doi: 10.1016/S0968-0160(02)00010-8. [PubMed] [CrossRef] [Google Scholar]
21. Mittal Y, Fehring TK, Hanssen A, Marculescu C, Odum SM, Osmon D. Two-stage reimplantation for periprosthetic knee infection involving resistant organisms. J Bone Joint Surg Am. 2007;89:1227–1231. doi: 10.2106/JBJS.E.01192. [PubMed] [CrossRef] [Google Scholar]
22. Mortazavi SM, Vegari D, Ho A, Zmistowki B, Parvizi J. Two-exchange arthroplasty for infected total knee arthroplasty: predictors of failure. Clin Orthop Relat Res. 2011;469:3049–3054. doi: 10.1007/s11999-011-2030-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
23. Nahabedian MY, Mont MA, Orlando JC, Delanois RE, Hungerford DS. Operative management and outcome of complex wounds following total knee arthroplasty. Plast Reconstr Surg. 1999;104:1688–1697. doi: 10.1097/00006534-199911000-00012. [PubMed] [CrossRef] [Google Scholar]
24. Nahabedian MY, Orlando JC, Delanois RE, Mont MA, Hungerford DS. Salvage procedures for complex soft tissue defects of the knee. Clin Orthop Relat Res. 1998;356:119–124. doi: 10.1097/00003086-199811000-00017. [PubMed] [CrossRef] [Google Scholar]
25. Panni AS, Vasso M, Cerciello S, Salgarello M. Wound complications in total knee arthroplasty: which flap is to be used? With or without retention of prosthesis? Knee Surg Sports Traumatol Arthrosc. 2011;19:1060–1068. doi: 10.1007/s00167-010-1328-5. [PubMed] [CrossRef] [Google Scholar]
26. Parvizi J, Zmistowski B, Berbari EF, Bauer TW, Springer BD, Della Valle CJ, Garvin KL, Mont MA, Wongworawat MD, Zalavras CG. New definition for periprosthetic joint infection: from the Workgroup of the Musculoskeletal Infection Society. Clin Orthop Relat Res. 2011;469:2992–2994. doi: 10.1007/s11999-011-2102-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
27. Ries MD. Skin necrosis after total knee arthroplasty. J Arthroplasty. 2002;17(4 suppl 1):74–77. doi: 10.1054/arth.2002.32452. [PubMed] [CrossRef] [Google Scholar]
28. Ries MD, Bozic KJ. Medial gastrocnemius flap coverage for treatment of skin necrosis after total knee arthroplasty. Clin Orthop Relat Res. 2006;446:186–192. doi: 10.1097/01.blo.0000218723.21720.51. [PubMed] [CrossRef] [Google Scholar]
29. Sanders R, O’Neill T. The gastrocnemius myocutaneous flap used as a cover for the exposed knee prosthesis. J Bone Joint Surg Br. 1981;63:383–386. [PubMed] [Google Scholar]
30. Sherrell JC, Fehring TK, Odum S, Hansen E, Zmistowski B, Dennos A, Kalore N, Periprosthetic Infection Consortium The Chitranjan Ranawat Award: fate of two-stage reimplantation after failed irrigation and débridement for periprosthetic knee infection. Clin Orthop Relat Res. 2011;469:18–25. doi: 10.1007/s11999-010-1434-1. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
31. Tan KJ, Lim CT, Lim AY. The use of muscle flaps in the salvage of infected exposed implants for internal fixation. J Bone Joint Surg Br. 2010;92:401–405. doi: 10.1302/0301-620X.92B3.22115. [PubMed] [CrossRef] [Google Scholar]
32. Tetreault MW, Wetters NG, Aggarwal VK, Moric M, Segreti J, Huddleston JI, 3rd, Parvizi J, Della Valle CJ. Should draining wounds and sinuses associated with hip and knee arthroplasties be cultured? J Arthroplasty. 2013;28(8 suppl):133–136. doi: 10.1016/j.arth.2013.04.057. [PubMed] [CrossRef] [Google Scholar] |


