马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
介绍
本章概述了耳鼻喉科中常见的抗生素,并总结了微生物谱,临床适应症和不良反应。概述了选择抗生素的临床方法。强调抗生素炖汤,强调适当使用抗生素。
目前全世界都在关注抗生素管理。抗生素管理计划旨在通过确保只在需要时,以正确的剂量和最短的持续时间给予正确的抗生素来改善患者护理和患者安全[1]。抗生素管理是所有抗生素处方者的责任。应该努力了解何时以及为何需要抗生素以及何时停止使用抗生素。
多药耐药性感染已变得更加普遍。疾病控制和预防中心(CDC)将多药耐药生物(MDRO)定义为对一种或多种抗生素具有抗性的生物。抗生素耐药性是一个新兴的地方,国家和国际问题。疾病预防控制中心,世界卫生组织和联合国都将抗生素耐药性作为首要任务,并支持防治抗药性出现的计划。抗生素的研究和开发继续落后于对新药的需求。
疾病预防控制中心估计,每年在美国,有200万人因MDRO而感染,至少有23,000人死于这些感染[2]。抗生素的使用是导致MDRO的最重要的风险因素[2]。估计不适当使用抗生素会影响13-39%的住院患者和高达30%的门诊患者[3,4]。约三分之一的门诊抗生素用于治疗中耳炎,鼻窦炎和咽炎,建议将窄谱抗生素作为国家指南的一线治疗[4]。在2010年至2011年的美国,这些疾病的处方中只有52%用于一线窄谱剂[5]。改善适当的抗生素使用将有助于降低抗生素耐药性。
一般考虑因素
抗生素选择
选择合适的抗生素取决于几个因素:(1)疑似感染(如中耳炎,肺炎,脓肿); (2)可能的生物和抗生素的易感性; (3)宿主因素(如免疫抑制,抗生素过敏); (4)抗生素特性(例如剂量,给药途径,潜在毒性)。
最初的抗生素治疗通常是经验性和广谱性的,涵盖可能引起特定感染的各种生物。例如,可以在万古霉素,头孢吡肟和甲硝唑上开始患有来自未知来源的败血症的患者,以根据经验对革兰氏阳性,革兰氏阴性和厌氧细菌进行治疗。应尽可能在开始使用抗生素之前获得微生物标本,以增加分离致病病原体的可能性。一旦获得培养结果,就应该定制抗生素。
局部抗菌谱可以帮助指导最初的经验性抗生素选择,特别是在重症患者中。抗菌谱在特定机构或地方或区域层面提供常见病原体的易感性。还应考虑每位患者的MDRO风险因素。 MDOCs的危险因素已经在重症监护病房和肺炎患者中进行了研究[6,7]。这些MDRO风险因素包括在过去90天内接受静脉注射抗生素,在疗养院居住,以及在过去6个月内延长住院时间[6,7]。
流体的革兰染色可以为感染的病因学提供早期线索。培养和药敏试验可能需要数天时间。聚合酶链反应测试可用于快速鉴定一些病原体(例如呼吸道病毒)。随着临床和微生物学数据的出现,应调整抗生素(定向治疗)。如果进行非细菌诊断,应停止使用抗菌剂。
抗生素敏感性和感染部位
通常在阳性培养物中对细菌分离物进行抗生素敏感性测试。微生物学实验室测试细菌对各种可能有效的抗生素的易感性。易感性测试指南由临床和实验室标准研究所标准化,并且通常报告为最小抑制浓度(MIC),其具有易感,中间或抗性的解释。 MIC是抑制细菌生长所需的最低抗生素浓度。 MIC因生物体和抗生素而异,并且不一定与抗生素直接相当。
抗生素只有在充分传递到感染部位才有效,而且这种情况因药剂和剂量而异。抗生素渗透并在不同的体液中达到不同的浓度。例如,患有金黄色葡萄球菌脑膜炎的患者不应该用头孢唑啉治疗,因为这种抗生素确实在脑脊液中达到治疗浓度。同样,由于抗生素渗透到脓肿中,患有颈部脓肿未暴露的患者可能无法单独使用抗生素。
抗生素给药
抗生素给药可以基于年龄,体重,肾功能,感染位置,靶向生物体及其易感性特征(如果已知)。如果可能的话,应该避免使用一些抗生素,因为毒性风险会增加[8,9]。建议在儿童中使用基于体重的抗生素剂量,有时在超重或体重不足的成人中。对于某些抗生素,例如万古霉素,也推荐基于体重的剂量给药。
许多抗生素需要根据肾功能进行调整。给药应基于估计的肌酐清除率。一些抗生素可引起肾功能障碍,并且需要在使用期间密切监测电解质,肌酸酐和药物水平(例如,万古霉素和氨基糖苷类)。
当患者出现严重疾病或患重病时,抗生素几乎总是静脉注射。随着患者的改善,口服抗生素可能是合适的替代品,取决于临床综合症。抗生素的生物利用度各不相同。某些抗生素,如氟喹诺酮类,利奈唑胺,阿奇霉素,克林霉素,强力霉素,甲硝唑,和复方新诺明,具有很好的口服生物利用度,而其他,如青霉素和头孢菌素,不要。值得注意的是,口服生物可利用性可能被食物或其他药物(例如抗酸剂或铁补充剂)改变,并且处方临床医生应该知道这种相互作用。
共病条件
合并症可能会改变导致临床综合症的病原体的鉴别诊断。免疫抑制的患者(例如,患有HIV,器官或骨髓移植的患者,接受癌症的化疗,接受免疫抑制治疗的风湿病)对于来自更广谱病原体的感染比对免疫能力的宿主更敏感。例如,接受TNFα(肿瘤坏死因子α)抑制剂如英夫利昔单抗,阿达木单抗或依那西普的患者结核病和真菌感染的风险增加[10]。糖尿病患者即使其糖尿病得到良好控制也容易受到假单胞菌侵袭性外耳炎的影响,并且糖尿病失控的患者易患鼻炎性毛霉菌病。在评估患者时,应考虑接触最近和远程的病人,动物和旅行,因为这些因素也可能改变导致疾病的可能生物。
怀孕和哺乳期
选择抗生素时需要考虑妊娠和哺乳期。必须考虑孕妇和胎儿或母乳喂养母婴的安全性[11]。胎盘组织和母乳中的抗生素浓度不同。剂量也会有所不同,因为妊娠相关的肾小球滤过率增加可能会更快地清除抗生素。检查抗生素的选择和患者的产科医生或婴儿的儿科医生的剂量是至关重要的。美国食品和药物管理局(FDA)也描述了怀孕和哺乳期间各种抗生素的安全性。
不良反应和过敏
抗生素并发症很常见,包括过敏反应,药物毒性和MDRO感染的发展。在美国,16%的不良药物事件急诊室就诊是由抗生素引起的,5岁及以下儿童的这一比例增加到56%,6-19岁儿童的这一比例增加到32%[12]。减少不适当的抗生素使用将减少需要急诊室就诊的不良反应的风险。
在抗生素处方之前应确认抗生素过敏。抗生素引起各种反应,包括斑丘疹,荨麻疹,史蒂文斯 - 约翰逊综合症,药物热和过敏反应。应将真正的过敏反应与抗生素相关的副作用区分开来,例如轻度胃肠道不适。大约10%的普通人群报告对青霉素过敏(某些系列中为15.6%)[13]。然而,高达90%的这些人对青霉素并非真正过敏,并且被不必要地贴上标签[14]。 β-内酰胺类抗生素是许多感染的首选抗生素,广谱,非β-内酰胺类药物的替代治疗可能导致较差的结果,较高的MDRO和艰难梭菌感染率,以及较长的停留时间[14-16] 。测试剂量或“分级挑战”程序可允许许多报告青霉素或头孢菌素过敏的患者安全地接受β-内酰胺抗生素。在波士顿一家大型教学医院引入的测试剂量方案导致β-内酰胺的使用增加,并且减少了一些替代抗生素(万古霉素,氟喹诺酮类,氨基糖苷类,氨曲南胺)的使用,但没有增加不良反应药物事件[17]。
药物毒性和副作用因抗生素而异,可能与剂量有关(表1.1)。腹泻可能在抗生素过程中或之后发生,并且可能是抗生素的副作用或由于艰难梭菌感染引起的。抗生素改变了胃肠道的正常微生物组,使艰难梭菌过度生长,其毒素可引起频繁的水样腹泻,发热,白细胞增多,并且在严重的情况下,中毒性巨结肠,肠穿孔和死亡。每年在美国大约有250,000人患上艰难梭菌感染,导致14,000人死亡[2]。这些感染中有一半发生在住院或近期住院的患者中,而大约一半发生在养老院的居民或最近在医生诊室或诊所照顾的患者[2]。许多感染与目前或最近的抗生素使用有关。一些抗生素类比其他类别具有更高的风险。克林霉素,氟喹诺酮类和头孢菌素具有社区获得性艰难梭菌感染的最高风险,分别比没有抗生素的风险增加20倍,6倍和4倍[18]。英国最近的一项研究发现,在全国范围内减少氟喹诺酮的使用导致全国衰弱的艰难梭菌感染[19]。适当的抗生素使用专注于窄谱剂,持续时间最短,具有最佳的治疗效果,也有助于减少艰难梭菌感染。
表1.1抗生素毒性和副作用

治疗持续时间
治疗持续时间因感染类型,致病病原体和使用的抗生素而异。应对社会指南进行审查,包括来自美国传染病学会(IDSA)的治疗指南,可在idsociety IDSA_Practice_Guidelines上查阅。较短的抗生素持续时间似乎与尿路感染,社区和医院获得性肺炎的持续时间较长以及腹腔内感染引起的[7,20-22]一样有效。然而,最近一个短期抗生素治疗失败的例子是6-23个月儿童的急性中耳炎:治疗5天导致治疗效果不如10天治疗[23]。持续时间较长的抗生素与不良反应增加有关,包括药物的毒性,抗生素耐药性的发展以及艰难梭菌感染的风险增加[2]。
降低治疗效果
在接受经验性抗生素治疗的住院患者中,应在48-72小时内重新评估对抗生素治疗的需求。该时间范围允许微生物数据成熟并用于评估临床情况和潜在反应或对抗生素治疗无应答。如果可能的话,应该减少抗生素的含量。如果可能有另一种解释,“对治疗的反应”不应该是抗生素持续的唯一原因。此外,文化数据应该被解释为批判性地包括阳性培养物代表感染而不是感染的潜力。例如,患有气管造口术的稳定患者可能会从气管造口术培养出高抗性细菌。对于没有活动性感染迹象或症状的患者,可能不需要治疗这些细菌。
外科抗生素预防
手术的抗生素预防针对可能在手术时污染伤口的细菌。建议对几乎所有清洁污染的外科手术和一些清洁外科手术进行抗生素预防。皮肤菌群,尤其是金黄色葡萄球菌和链球菌,特别是A组链球菌,是预防干净外科手术的主要目标。对于清洁污染的手术,需要使用更广谱的抗生素,因为这些抗生素还必须覆盖呼吸道或胃肠道的菌群。应在手术切口前1小时(或万古霉素和氟喹诺酮类药物在2小时内)开始使用抗生素最有效[24,25]。对于较长的手术,抗生素可能需要在术中再次使用[24]。超过皮肤闭合的预防性抗生素的延续尚未显示可改善预后[24],并且CDC建议在手术室切口闭合后停止预防性抗生素,即使存在引流[26]。在第二章中进一步讨论了耳鼻喉科的外科预防。 30。
 
抗菌剂
β-内酰胺类抗生素
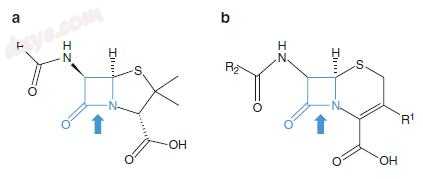
β-内酰胺类抗生素包括青霉素,头孢菌素,碳青霉烯类和单环内酰胺类。 β-内酰胺类抗生素具有四元核心环结构(图1.1)并具有杀菌作用。它们抑制细菌细胞壁的合成。表1.2总结了常用的β-内酰胺类抗生素,它们的一般活性谱和常见适应症。
青霉素类。青霉素于1941年首次用于治疗英国牛津的一名患者。除了链球菌外,它对金黄色葡萄球菌也有初步疗效,但葡萄球菌的耐药性迅速发展。然而,A组链球菌从未对青霉素产生耐药性。甲氧西林是1961年开发的一种青霉素衍生物,具有抗金黄色葡萄球菌的功效,但后来被毒性较小的替代品,萘夫西林和苯唑西林所取代。名称“甲氧西林”保留在“甲氧西林敏感的金黄色葡萄球菌”(MSSA)和“耐甲氧西林金黄色葡萄球菌”(MRSA)中,表示对β-内酰胺类抗生素如苯唑西林,萘西林的易感性或耐药性,氨苄西林 - 舒巴坦,头孢唑啉,头孢呋辛,头孢曲松和头孢吡肟。
头孢菌素。第一个头孢菌素于1961年在英国牛津分离,第一个临床上有用的头孢菌素头孢菌素于1964年上市。随后多头头孢菌素的开发导致其在“世代”中的分类(表1.2)。区分各种头孢菌素的临床上重要的特征包括它们对金黄色葡萄球菌(例如头孢唑啉,头孢呋辛,头孢吡肟),肺炎链球菌(例如头孢曲松),厌氧菌(例如头孢西丁)和革兰氏阴性杆菌的活性。所有头孢菌素都具有抗革兰氏阴性杆菌的活性,但易感病原体的数量通常随着头孢菌素的产生而增加。具有抗假单胞菌活性的少数头孢菌素(例如,头孢他啶,头孢吡肟)是值得注意的。在第五代头孢菌素,头孢托吡酯和头孢洛林出现之前,没有一种头孢菌素类具有抗MRSA的活性。
图1.1β-内酰胺类抗生素,核心结构。 (a)青霉素; (b)头孢菌素。 “R”是变量组。 β-内酰胺环呈蓝色。箭头指向细菌β-内酰胺酶的作用位点
碳青霉烯类抗生素。碳青霉烯类提供广泛的抗菌疗法,可治疗革兰氏阳性球菌,革兰氏阴性杆菌和厌氧菌。它们对大多数具有超广谱β-内酰胺酶(ESBL)或AmpCβ-内酰胺酶(细菌抗性机制)的细菌也具有活性。它们是静脉内给药的,包括多利培南,厄他培南,亚胺培南 - 西司他丁和美罗培南。它们对MRSA或嗜麦芽寡养单胞菌没有活性。厄他培南对假单胞菌或不动杆菌没有活性。碳青霉烯类具有良好的穿透性,包括中枢神经系统在内的许多组织中,并且由于其广泛的活性而成为有价值的药物。与所有抗生素一样,在治疗期间可能会出现耐药性,这些药物只能在无法使用较窄谱抗生素的情况下使用。
单酰胺菌素。迄今为止唯一获得FDA批准的单一反应物是氨曲南,一种抗生素,具有与庆大霉素和其他氨基糖苷类似的活性谱,但毒性显著降低。 Aztreonam对革兰氏阴性菌有效,包括假单胞菌,但对革兰氏阳性菌或厌氧菌没有活性。 Aztreonam主要用于治疗严重青霉素或头孢菌素过敏患者的革兰氏阴性菌感染,因为几乎所有β-内酰胺类过敏症患者都能耐受氨曲南[27,28]。 Aztreonam与头孢他啶具有相似的侧链,应该对头孢他啶过敏患者慎用[29]。 Aztreonam可用于治疗各种感染,包括菌血症,尿道感染,骨和关节感染,以及皮肤和软组织感染。在需要广谱治疗的病例中,可以与革兰氏阳性抗生素联合使用。
氨基糖苷类
氨基糖苷类(例如阿米卡星,庆大霉素,妥布霉素)通常与β-内酰胺抗生素组合用于治疗某些类型的细菌性心内膜炎和革兰氏阴性感染。氨基糖苷类具有抗几乎所有革兰氏阴性杆菌(包括铜绿假单胞菌)的活性,并且与氨苄青霉素协同作用以治疗由易感肠球菌引起的严重感染。一些氨基糖苷类(例如链霉素)用作治疗多药耐药性分枝杆菌感染方案的一部分。氨基糖苷类的临床应用主要用于治疗耐药性生物,因为肾功能不全和耳毒性是显著的副作用。应经常监测肾功能和血清峰值和氨基糖苷类水平。应警惕患者耳毒性的可能性,并应监测听力和前庭功能,除非预计氨基糖苷类疗程非常简短。耳毒性可影响听力和/或前庭功能,通常始于高频感觉神经性听力丧失。患者可能不了解这一点,但可以在听力测试中检测到。前庭毒性可能比听觉毒性更普遍。一项针对71名囊性纤维化患者的研究,这些患者接受过氨基糖苷酶治疗假单胞菌的疗程,但这并不是包罗万象,也不是为了指导特定感染的治疗。此外,美国食品和药物管理局(FDA)使用的适应症可能比“常见用途”中列出的更为有限,或者在某些情况下更广泛。抗生素的一些常见用途是“不标签”,并且一些病原体不属于抗生素具有FDA批准用途的那些。列出的一些病原体可能具有对相应抗生素具有抗性的分离株。对于给定抗生素而言,一些常见用途可能仅适用于该抗生素与另一种抗生素联合使用的情况。
                
表1.2选择β-内酰胺类抗生素及其常见用途
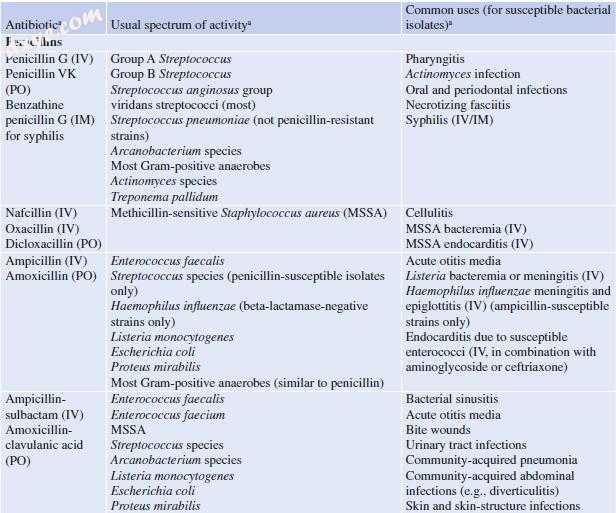
IV =静脉注射,PO =口服(口服),IM =肌内注射,MSSA =甲氧西林敏感金黄色葡萄球菌,MRSA =耐甲氧西林金黄色葡萄球菌
感染 - 发现79%有前庭功能障碍,23%有听力损失(有些同时有)[30]。通常不可逆的耳毒性可在完成氨基糖苷类过程后或甚至数周内开始。
克林霉素
克林霉素对易感金黄色葡萄球菌和链球菌属以及许多厌氧革兰氏阳性球菌如消化链球菌具有活性。它对革兰氏阴性杆菌没有活性,对抗厌氧革兰氏阴性杆菌如脆弱拟杆菌的活性越来越差。克林霉素常用于治疗MRSA皮肤和软组织感染,尽管在美国某些地区MRSA对克林霉素的耐药率很高(20-25%)[31,32]。克林霉素还用于治疗青霉素过敏患者中的一些金黄色葡萄球菌(MSSA)和链球菌感染,但是这些病原体中克林霉素抗性的增加也是一个问题。最近一项针对威斯康星州儿童A组链球菌性咽炎的研究报道,克林霉素耐药率为15%[33]。克林霉素具有优异的口服生物利用度,但患者通常比口服克林霉素耐受更高剂量的静脉注射。克林霉素被肝脏清除,应在肝功能障碍中进行剂量调整。
达托霉素
2003年FDA批准的达托霉素是一种脂肽。它仅可通过静脉注射获得,并且仅具有抗革兰氏阳性细菌的活性。它对大多数革兰氏阳性细菌具有活性,包括耐药细菌如MRSA和耐万古霉素肠球菌(VRE)。它被批准用于治疗复杂的皮肤和软组织感染,金黄色葡萄球菌菌血症和右侧心内膜炎。它不应用于肺炎和其他肺部感染,因为它在表面活性剂存在下无效。达托霉素给药是基于体重的,并且药物通常耐受良好。肌酐磷酸激酶(CPK)应每周随访一次,用于治疗相关的肌病。
氟喹诺酮类药物
氟喹诺酮类药物是具有优异口服生物利用度的广谱药物,口服和静脉内剂量在胃肠道吸收正常的患者中达到相似的血清水平。口服药物,如一些含有二价和三价阳离子(镁,铝,铁或钙)的抗酸和膳食补充剂,可能会显著减少口服喹诺酮吸收,应至少在喹诺酮前2小时给药。喹诺酮类药物具有优异的渗透性,包括骨骼在内的组织。环丙沙星主要对革兰氏阴性菌有活性,包括肠道革兰氏阴性杆菌和铜绿假单胞菌。左氧氟沙星具有抗链球菌的额外活性,包括肺炎链球菌和非典型病原体如军团菌和支原体,使其可用于治疗社区获得性肺炎。莫西沙星与左氧氟沙星相似,但对厌氧菌具有一定的活性,对假单胞菌的活性更低。
氟喹诺酮类药物的广泛使用导致耐药性增加,提供者应该考虑使用它们[34,35]。此外,在2016年,FDA发布了关于喹诺酮类药物严重不良反应的安全公告,包括肌腱炎,肌腱撕裂,感觉异常,肌肉和关节疼痛以及中枢神经系统的影响[3​​6]。美国食品和药物管理局表示,全身氟喹诺酮类药物不应用于急性细菌性鼻窦炎,急性支气管炎和无并发症的尿路感染的其他治疗方案[36]。
利奈唑胺和噻唑烷(恶唑烷酮)
利奈唑胺是第一个获得FDA批准(2003年)的新一类抗生素,即恶唑烷酮的成员。 Tedizolid是第二代恶唑烷酮(FDA批准的2014年),比利奈唑胺对葡萄球菌和肠球菌更有效。两种抗生素均可通过静脉内和口服方式获得,并用于治疗革兰氏阳性细菌引起的感染,包括耐药的革兰氏阳性细菌,如MRSA和VRE。它们还具有针对某些分枝杆菌的活性,并且可以作为霉菌的组合方案的一部分使用(标签外使用)。它们具有良好的口服生物利用度和组织渗透性。利奈唑胺可用于治疗由于革兰氏阳性细菌引起的菌血症,肺炎和复杂的皮肤和软组织感染。利奈唑胺的使用可引起血细胞减少,尤其是血小板减少症,而tedizolid不太可能发生血小板减少[37,38]。长期使用这些抗生素可引起外周神经病变,很少引起视神经病变。 Tedizolid目前仅被批准用于治疗皮肤和软组织感染。
大环内酯类
大环内酯类,包括红霉素,克拉霉素和阿奇霉素,主要用于治疗社区获得性肺炎,常用于治疗青霉素过敏性患者的咽炎。克拉霉素和阿奇霉素对易感肺炎链球菌(尽管耐药性增加),嗜肺军团菌,卡他莫拉菌和流感嗜血杆菌具有活性。大约15%的A组链球菌咽炎同种异体对大环内酯类耐药[33],而大环内酯对坏死梭杆菌(Fusobacterium necrophorum)无效,这是青少年咽喉炎的重要原因,也是Lemierre综合征的主要原因。阿奇霉素可通过静脉内和口服给药,每日一次,并且比其他大环内酯类耐受性更好。克拉霉素只能口服。红霉素通常由于胃肠道副作用而耐受性差,并且它通常在重症监护病房中用作胃肠动力剂。阿奇霉素和克拉霉素是非结核分枝杆菌感染治疗方案的重要组成部分。伴有恶心,呕吐,腹痛和腹泻的胃肠道不适是一种常见的副作用(阿奇霉素较少),并且在治疗时可能发生QT延长。
甲硝唑
甲硝唑对几乎所有革兰氏阴性厌氧菌都有活性,包括梭菌属,拟杆菌属和梭杆菌属。它对许多革兰氏阳性厌氧菌具有较差的活性(见第2章),对抗好氧细菌无活性。口服甲硝唑吸收良好。它通常与对革兰氏阳性和革兰氏阴性需氧菌有效的抗生素联合使用,以提供广谱覆盖。它已被用作艰难梭菌感染的初始治疗多年,但最近的证据表明口服万古霉素是优越的[39-41]。甲硝唑可引起金属味,当用于延长疗程时,可引起周围神经病变。
四环素
四环素对革兰氏阳性和革兰氏阴性细菌以及非典型药物如支原体,立克次氏体和伯氏疏螺旋体(美国莱姆病的主要原因)具有活性。多西环素可以静脉内和口服使用,并且比美国的四环素更常用。四环素可以用于治疗由支原体或肺炎衣原体引起的非典型肺炎。尽管许多MRSA分离株具有抗性,但这些药物也用于治疗由MRSA引起的皮肤和软组织感染。使用四环素可能会发生阳光敏感(晒伤),应建议患者涂防晒霜。替加环素是一种四环素衍生物,仅在2005年获得FDA批准。但是,替加环素在2010年接受了FDA“黑匣子警告”,原因是用替加环素治疗的患者中观察到的全因死亡率增加药物。替加环素治疗患者死亡率较高的原因尚不清楚。替加环素具有广谱活性,主要用于治疗那些对其他抗生素有抗药性的MDRO感染。它对假单胞菌没有活性。替加环素不能达到高血清浓度,不应用于菌血症。
复方新诺明
甲氧苄氨嘧啶 - 磺胺甲恶唑对葡萄球菌以及革兰氏阴性菌具有活性,所述革兰氏阴性菌包括流感嗜血杆菌,大肠杆菌,奇异变形杆菌和嗜麦芽寡养单胞菌。它具有出色的生物利用度。它是由易感病原体引起的泌尿道感染的一线药物,可用于治疗敏感的MRSA皮肤和软组织感染。重要的是要了解MRSA的局部敏感性,以确保甲氧苄氨嘧啶 - 磺胺甲恶唑提供足够的治疗。它还可用于预防CD4计数低的HIV患者以及实体器官和造血干细胞移植受者中的肺孢子虫肺炎(Pneumocystis jivorecii pneumonia)。
万古霉素和其他糖肽
万古霉素。万古霉素于1958年获得FDA批准,仅对革兰氏阳性菌具有活性。静脉注射万古霉素主要用于治疗由耐药性葡萄球菌,链球菌和肠球菌引起的感染,而口服万古霉素用于治疗艰难梭菌感染。口服万古霉素不被吸收,因此不能用于治疗全身性感染。静脉注射万古霉素是易感MRSA感染的首选药物,包括菌血症和肺炎。万古霉素可用于治疗不能进行β-内酰胺治疗的患者的金黄色葡萄球菌(MSSA)感染,但β-内酰胺类抗生素可更快地清除MSSA菌血症。剂量基于肾功能和体重。应监测血清万古霉素谷浓度以达到治疗药物浓度和最小化毒性。高剂量可发生肾毒性。 “红人综合症”是由于组胺释放引起的万古霉素输注反应,其表现为皮疹,瘙痒,潮红和一些低血压。它通常在快速输注抗生素的情况下发生,并且通常可以通过较慢的输注速率来避免。
其他糖肽。 特拉万星,达巴万星和奥利万星是2009年(telavancin)和2014年(dalbavancin,oritavancin)FDA批准的脂溶肽。它们与万古霉素属于相同的抗生素类并且具有相似的活性,但是这些新药具有每日一次给药(特拉万星)或每周一次给药(达巴万星和奥利万星)的优点。每周一次的治疗方案仅适用于皮肤和软组织感染。使用这些药物应在传染病专家的指导下进行。
尿路感染的其他抗生素
磷霉素和呋喃妥因。磷霉素和呋喃妥因是可用于治疗无并发症的尿路感染的口服剂。磷霉素可以一次性剂量给药。呋喃妥因只能用于肾功能相对正常的患者,因为它需要充分排泄到尿液中才能有效。这些药物与甲氧苄氨嘧啶 - 磺胺甲恶唑一起,是治疗因易感细菌引起的并发尿路感染的绝佳方法[20]。
治疗多药耐药菌感染
对于MDRO感染,建议咨询传染病专家。上面讨论的几种抗生素,例如利奈唑胺,被批准用于治疗由抗性革兰氏阳性细菌引起的感染,包括MRSA和VRE。为了治疗由革兰氏阴性杆菌引起的感染,有几种选择,但治疗应以药敏试验结果为指导。 Ceftolozane-tazobactam和ceftazidime-- avibactam最近已被批准(分别为2014年,2015年)用于治疗尿路感染和腹腔内感染。 Ceftolozane-tazobactam被开发用于治疗高度耐药的铜绿假单胞菌。它还具有抗许多其他MDRO革兰氏阴性杆菌的活性,但不具有对碳纳米管有效的活性。头孢他啶-avibactam对抗革兰氏阴性杆菌具有活性,包括一些产生碳青霉烯酶的杆菌。
用于高度耐药性生物的其他抗生素包括替加环素和多粘菌素(例如粘菌素)。这些药物主要是最后的药物,应该在传染病专家的指导下使用。
抗真菌药
真菌感染通常分为酵母感染和霉菌感染。耳鼻喉科的大多数酵母菌感染都是由念珠菌引起的。霉菌感染,例如由曲霉菌和毛霉菌病引起的霉菌感染,比念珠菌感染更难以治疗。一般而言,具有抗霉菌活性的抗真菌抗生素也可治疗念珠菌,而反之亦然。念珠菌属物种的抗真菌易感性测试结果具有临床意义(与治疗反应相关),但对于霉菌则不然。对于侵入性霉菌感染的治疗,已经证明使用各种抗真菌剂的临床试验的结果在指导治疗中是最可靠的。
两性霉素。两性霉素B几乎治疗所有霉菌和念珠菌属,但具有显著的毒性,包括肾脏。脂质体两性霉素至少与两性霉素B一样有效并且具有显著较低的肾毒性,但是更昂贵。两种药剂都只能静脉注射。
唑类。美国可获得的主要唑类是氟康唑,伊曲康唑,伏立康唑,泊沙康唑,最近是异硫脲硫酸盐(代谢成异维康唑)。唑类具有高生物利用度,因此口服和静脉内制剂通常达到相似的血清水平。氟康唑实现了极好的组织穿透,并且几乎对所有白色念珠菌菌株都有效,尽管其他一些念珠菌属可能具有抗药性。氟康唑对霉菌无效。伊曲康唑具有一定的抗霉菌活性,但治疗血清药物水平难以达到,伊曲康唑对曲霉菌的效果不如伏立康唑。伏立康唑可口服和静脉注射,是侵袭性曲霉菌感染的首选治疗方法。它还具有针对一些其他霉菌(例如,镰刀菌)的活性,但不会对抗引起毛霉菌病的霉菌(例如,Rhizopus,Mucor)。口服伏立康唑具有优异的生物利用度。泊沙康唑具有抗真菌的活性,可引起毛霉菌病,可口服和静脉注射。泊沙康唑仅在FDA批准用于治疗折返性口咽念珠菌病,并用于高风险患者(如免疫受损宿主)的侵袭性曲霉菌和念珠菌感染的预防性治疗。在用两性霉素或脂质体两性霉素治疗的初始疗程后,泊沙康唑经常用作侵袭性霉菌感染例如毛霉菌病的降压口服疗法。 Isavuconazonium sulfate(代谢为isavuconazole)可通过静脉内和口服方式获得,具有广谱抗真菌活性,包括对曲霉菌和毛霉菌病的作用。见Chap。图15讨论了侵袭性真菌性鼻窦炎。肝毒性是唑类的重要副作用,肝功能检查应该是监测的。除了isavuconazonium sulfate之外,所有的唑类都可以延长QTc间期,在治疗期间应该密切监测。 Isavuconazonium sulfate可以缩短QTc间期。唑类通过肝脏的CYP3A4途径代谢,因此具有许多药物 - 药物相互作用。在开具唑类药物之前,医疗保健提供者应评估与患者其他药物的潜在相互作用。
棘白菌素。 Echinocandins,包括caspofungin和micofungin,主要用于治疗因氟康唑耐药的念珠菌属引起的严重感染。棘白菌素通常耐受性良好,但仅可通过静脉注射获得。
结论
1932年发现磺胺类药物并于1941年首次临床使用青霉素,迎来了现代抗生素时代。然而,每种新抗生素的引入都伴随着对该抗生素的微生物抗性的发展。现在许多细菌对多种抗生素有抵抗力。临床医生必须适当和谨慎地使用抗生素,因为不必要的抗生素使用有助于选择越来越耐药的生物。
参考:Infections of the Ears, Nose, Throat, and Sinuses |


