马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
学习目标
•描述MRI和PET / CT在子宫恶性肿瘤的初始治疗选择,计划和反应评估中的作用
•解释宫颈癌保留生育力的资格标准
•突出显示可能区分子宫肉瘤与非典型平滑肌瘤(LM)的MR组合特征
18.1宫颈癌
18.1.1流行病学和诊断
18.1.2初始分期和管理
使用国际妇产科联合会(FIGO)分类进行宫颈癌的分期。由于发展中国家的流行率很高,它是临床上唯一的妇科恶性肿瘤。作为主要预后因素的淋巴结(LN)状态被排除在FIGO分期之外,因为临床检测是不可能的。对于FIGO阶段的正式分配,不接受横断面成像,但是在发达国家常规使用横截面成像来指导治疗决策。治疗选择由肿瘤分期和LN转移瘤的存在/位置决定(图18.1)。
18.1.3 MRI和初始分期
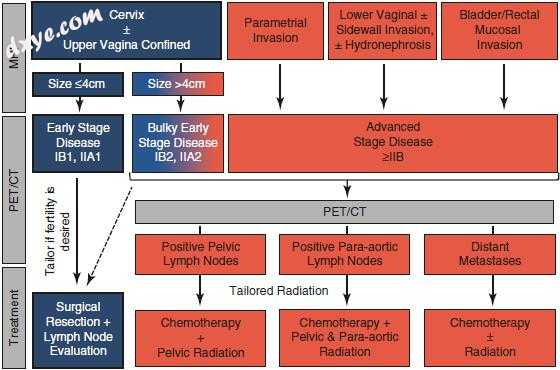
图18.1图(改编自)强调了MRI和PET / CT在评估宫颈癌新诊断患者的疾病程度和指导治疗决策中的作用

表18.1 MRI对宫颈癌和子宫内膜癌的分期
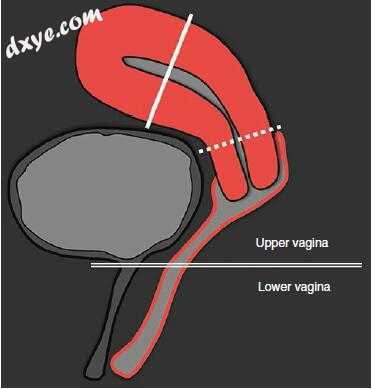
图18.2图示了短轴平面到阶段子宫内膜癌(垂直于子宫内膜的实线取向)和宫颈癌(垂直于子宫颈管取向的虚线)的取向。在膀胱基部/尿道连接处绘制双线并将阴道分成上部和下部
18.1.3.2第二阶段:宫颈+上部阴道疾病±宫旁入侵
IIA期入侵阴道上部(上部三分之二)但不侵入宫旁。与阶段IB类似,它分为IIA1(≤4cm)和IIA2(> 4cm)。当中度SI肿瘤在T2加权成像中破坏低SI阴道时诊断为阴道侵袭。在矢状T2加权成像的膀胱基部绘制的水平线将阴道分成上部和下部(图18.2)。
阶段IIB侵入了参数。完全丧失低 - T2 SI基质环并不总是表明宫旁入侵。如果肿瘤破坏低SI基质并导致针刺/结节性肿瘤 - 宫旁界面±包裹宫旁血管,则存在宫旁浸润(图18.4)。 DWI + T2加权成像提高了检测宫旁侵犯的特异性[10]。准确的诊断很重要,因为宫旁浸润表明同时化疗和放疗(CCRT)作为治疗选择(图18.1)。
18.1.3.3第三阶段:盆腔侧壁侵犯,下阴道受累,肾积水或非功能性肾
IIIA期侵入阴道下部。 IIIB期延伸至骨盆侧壁±引起肾积水。 瘤

图18.3患有IB1期宫颈腺癌的52岁女性。 矢状T2加权成像(a)和短轴T2加权成像(b)显示1.8cm肿瘤,中间SI为1
T2加权成像。 肿瘤涉及宫颈基质的部分厚度,具有完整的低SI基质环(箭头),排除涉及子宫下部,阴道上部(箭头)和宫旁区域的5.2cm肿瘤的宫旁侵犯。 肿瘤和宫旁之间有结节界面(箭头)。 还要注意右内髂LN(箭头)

表18.2对缺乏IB1期病变和对生育能力的女性进行保守治疗的选择标准
18.1.3.4第四阶段:膀胱/直肠粘膜
入侵或扩展超越
骨盆
IVA期侵犯膀胱/直肠粘膜; 当中间SI肿瘤破坏低SI肌壁并且在T2加权成像时延伸到粘膜中时存在侵袭。 单独的大疱性水肿(高SI粘膜)并不意味着IVA期[6]。 IVB期通过远处转移(包括骨盆外的LN转移)的存在来指示。

图18.4患有IIB期宫颈鳞状细胞癌的35岁女性。矢状T2加权成像(a),短轴T2加权成像(b)和融合T2加权成像+ DWI(c)证明
5.2厘米肿瘤,涉及子宫下部,上阴道(箭头)和宫旁区域。肿瘤和宫旁之间有结节界面(箭头)。还要注意右内髂LN(箭头)
18.1.4 PET / CT和初始分期
LN转移影响预后和治疗。在MRI(和CT)上,短轴直径≥1cm是一个主要的诊断标准,但产生低至中等敏感性,因为正常大小的LN转移仍然未被发现(图18.5)。 LN在DWI上显示出高SI,增加了它们的显着性(图18.4);然而,由于ADC值的重叠,DWI不用于区分良性和恶性LN [10]。 PET / CT可改善N和M分期,推荐用于≥1期的IB2疾病(图18.5)。
18.1.5初始治疗期间和之后的评估
在根治性子宫切除术后,如果临床上怀疑复发,则获得成像。在保留生育能力的手术后,建议在6个月时使用MRI,之后每年一次。
MRI和PET / CT可用于放射治疗(RT)计划。 例如,如果在治疗前PET / CT上存在副主动脉LN转移,则RT场扩展到主动脉旁区域(图18.1和18.5),并且中期治疗MRI允许基于残余肿瘤的体积/位置调整近距离放射治疗剂量。
T2加权成像的低SI基质表明无肿瘤的子宫颈,但异常信号可能在CCRT后持续长达6个月。 因此,在CCRT后3-6个月获得的PET / CT是有用的。 缺乏FDG亲合力表明复发风险低; FDG亲和力下降意味着中等风险; 并且未改变,增加或新的FDG亲合力病灶表明持续性疾病(图18.5)。 DWI和DCE在评估反应方面的作用是一个积极研究的领域。

图18.5与图18.4相同的患者。轴向T2加权成像和PET / CT图像显示0.5 cm短轴FDG-avid左主动脉旁(LN,a,b)。 (c)通过骨盆的基线轴向PET / CT图像显示FDG-avid宫颈肿瘤和右髂内LN(箭头)。 (d)在CCRT之后完全解决FDG的亲合力问题
18.1.6复发评估
复发性宫颈癌具有与原发病变相似的影像学特征[6]。在没有先前的盆腔RT的情况下,可以用CCRT接近局部复发。根治性手术是先前受照射的骨盆中唯一可能的治愈方法。 MRI和PET / CT对于确定合格性和定制手术范围至关重要。
18.1.7未来方向
PET / MRI可以提供“一站式”方法来评估原发性和复发性宫颈癌。
18.2.2初始分期和管理
使用FIGO系统手术分期子宫内膜癌。标准外科分期手术包括全腹子宫切除术,双侧输卵管卵巢切除术,LN切除术,腹膜冲洗术和网膜活检术。 FIGO阶段与预后很好地相关,但是术前分期仍然很重要,因为早期 - 低级别肿瘤可以用微创手术治疗并且可能不需要LN解剖。
18.2.3 MRI和初始分期
MR成像是确定肌层浸润深度的首选方式,与肿瘤分级,LN转移和5年生存率相关(表18.1)。矢状面和短轴面上的小视野高分辨率成像是MRI分期的主要部分(图18.2)。 T2加权成像,DCE和DWI的组合提供了最佳的诊断准确性。
具有高空间分辨率和更大视野的MRI在体积庞大的肿瘤,晚期和伴随的良性疾病(即子宫腺肌病和LM)中具有优于阴道内US的特别优势。
18.2子宫内膜癌
18.2.1流行病学和诊断
子宫内膜癌是全世界女性中第六位最常见的恶性肿瘤,也是发达国家最常见的妇科癌症。发病率稳步上升,主要原因是发达国家的寿命和肥胖增加。大约75%的病例发生在绝经后的女性中,> 90%的病例发生在绝经后的出血中。因此,大多数患者在早期被诊断出,该亚组的5年生存率> 90%。
初步评估包括盆腔超声(US)和管道子宫内膜活检或扩张和刮除术。绝经后妇女子宫内膜厚度为4-5 mm的阈值检测到子宫内膜癌,敏感性高达95%,特异性为77%。子宫内膜癌传统上根据生物学行为细分为两种类型:1型肿瘤是雌激素依赖性的,包括FIGO 1级和2级子宫内膜样腺癌,而2型肿瘤包括浆液性乳头状癌,透明细胞腺癌,癌肉瘤和FIGO级3个子宫内膜样腺癌。 2型肿瘤不依赖于雌激素,存在于更高的阶段,并且表现更积极。
18.2.3.1第一阶段:子宫限制性疾病
IA期局限于子宫内膜或子宫肌层的内半部,即子宫肌层厚度受累<50%(图18.6)。 IB期延伸至子宫肌层的外半部分(≥50%)(图18.7)。肿瘤在T2加权成像中具有中到低的SI,在DCE的后期阶段对子宫肌层呈低信号,并且显示出有限的扩散。然而,相对于正常子宫内膜,小肿瘤可以是同等或仅微小的低信号,并且在造影剂施用后早期相对于子宫内膜可以是高血管。肿瘤周围部分完整的低SI连接区表明没有深肌层浸润。
18.2.3.2第二阶段:宫颈间质入侵
第二阶段侵入并破坏T2加权成像的低SI宫颈基质。肿瘤的息肉样扩展到子宫颈管内或宫颈粘膜浸润不足以指定II期。超出宫颈进入宫旁的肿瘤扩展需要根治性子宫切除术。
18.2.3.3第三阶段:子宫血管的侵袭,
附件,阴道和/或骨盆或主动脉旁淋巴结
IIIA期侵入子宫浆膜,在T2加权成像中作为中间SI的区域出现,DCE上外部子宫肌层的正常边缘增强丧失。 直接肿瘤扩散到附件或卵巢转移被认为是IIIA期疾病。 区分同步卵巢病变从转移到卵巢是重要但具有挑战性的。 2型肿瘤具有较高的预发病概率,因此在该亚组中需要仔细寻找晚期肿瘤范围。

图18.6患有子宫内膜IA期子宫内膜样腺癌(2级)的62岁女性。 短轴(a)T2加权成像,(b)B1000 DWI和(c)延迟后钆3D T1加权成像显示在眼底和右侧角质层的基于子宫内膜的肿瘤(粗箭头)。 部分侵入子宫内膜的内半部分,连接区(细箭头)的薄边缘保持完整
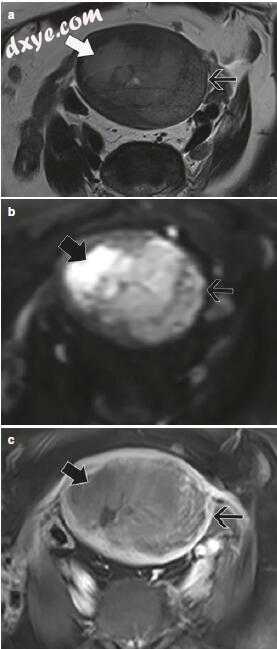
图18.7患有子宫内膜IB期子宫内膜样腺癌(3级)的76岁女性。短轴(a)T2加权成像,(b)B1000 DWI,和(c)延迟后钆3D T1加权成像显示侵入深部子宫肌层的大肿瘤(粗箭头)。除了浆膜受累外,沿着子宫的左侧有一个完整的外部子宫肌层(细箭头)的薄边缘
IIIB期通过连续扩散或转移受累涉及阴道。
当存在骨盆(IIIC期)和/或主动脉旁(IIIC期)LN转移性受累时,诊断为IIIC期。使用1cm的短轴截止值导致高特异性但是对于预测LN转移的灵敏度差(范围,36-89.5%)。尽管以特异性为代价,但0.8cm的截止值增加了灵敏度。在实践中,考虑到子宫内膜癌通过手术分期,重要的是提供短轴上超过0.5-0.6cm的LN的位置的大小和细节。 DWI和ADC在评估LN方面的作用与宫颈癌的描述相同。 PET / CT改善N和M分期;然而,PET / CT目前不是初期分期子宫内膜癌的标准治疗的一部分。
18.2.3.4第四阶段:膀胱/直肠粘膜
入侵或扩展超越
骨盆
请参阅“宫颈癌的MRI和初始分期”一节,因为子宫内膜癌和宫颈癌的发现相同。
18.2.4复发评估
复发性子宫内膜癌具有与原发性肿瘤相似的成像外观。 复发的危险因素包括晚期,高级别疾病和淋巴血管侵犯。 超过80%的复发发生在LN初始治疗的3年内(46%),阴道穹窿(42%)是最常见的部位。 MRI可用于评估骨盆限制性复发性疾病的手术切除率,而PET / CT有助于排除远处和LN转移。
以前被归类为子宫肉瘤,但现在被归类为高子宫内膜癌。
子宫肉瘤从头出现,与LM没有生物学联系。及时根治性手术是子宫肉瘤的标准治疗方法。相比之下,症状性LM可以通过传统手术(子宫切除术,子宫肌瘤切除术)或更新的微创/非侵入性策略(栓塞,消融,药物治疗)来实现。后者不会产生组织学诊断,突出了对精确初步诊断的需求。
子宫肉瘤和LM表现出类似的症状。大规模和快速增长是不可靠的恶性肿瘤迹象。绝经后子宫肿块的生长和LDH升高,特别是LDH同工酶3型,应被视为对LMS的怀疑。子宫内膜取样可能有助于子宫肉瘤的诊断,但由于子宫肌层来源,敏感性有限。
18.3.2成像的作用
如果在临床上怀疑子宫肉瘤或者计划对症状LM进行干预(以绘制肿瘤并排除肉瘤),则MRI是首选的成像方法。
没有单一的MR特征可以可靠地区分子宫肉瘤(包括LMS)和非典型LM(变性或组织学变异)。联合MR特征可能提示正确的诊断,包括单个大子宫肿块出血(T1加权成像时SI高),T2加权成像上的异质高SI,T2加权成像的浸润/结节边界和中心坏死。子宫肉瘤也表现出DCE上固体成分的快速早期增强和受限扩散(图18.8)。单独的扩散限制不足以用于诊断,因为可以用LM观察,尤其是细胞LM。
ESS通常表现出明显的MR特征,有助于诊断,包括具有子宫内膜成分的不明确的子宫肌层肿块,T2加权成像的蠕虫状低SI带(由肿瘤压缩的正常子宫肌层),以及沿输卵管,子宫周围血管的连续延伸,以及骨盆韧带。
18.3子宫肉瘤
18.3.1流行病学和介绍
子宫肉瘤是源自间充质的罕见侵袭性肿瘤,包含<3%的子宫体瘤。平滑肌肉瘤(LMS)是最常见的组织学亚型,其次是子宫内膜间质肉瘤(ESS)和未分化的子宫肉瘤。 ESS根据组织病理学和临床结果的差异细分为低级和高级ESS。癌肉瘤
关键点
•MRI优于宫颈癌和子宫内膜癌的局部分期治疗分层,而PET / CT可改善子宫恶性肿瘤的N和M分期。
•在早期宫颈癌和子宫内膜癌的生育能力保存之前,MRI有助于患者选择。
•MRI有助于表征临床疑似的子宫肉瘤。
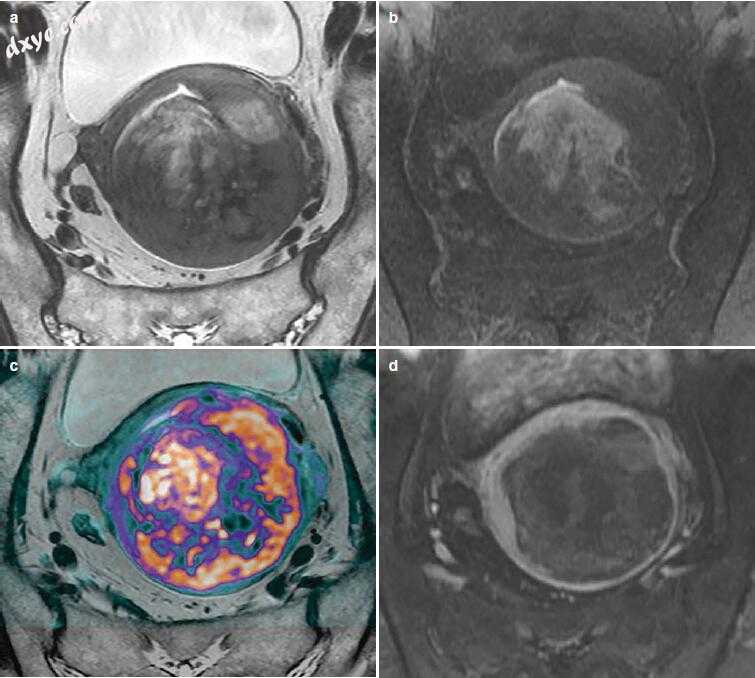
图18.8 69岁女性子宫肉瘤。 短轴图像显示不明确的子宫肌层肿块,T2加权成像具有异质性高SI(a),脂肪饱和T1加权出血
参考:Diseases of the Abdomen and Pelvis 2018-2021 Diagnostic Imaging - IDKD Book |


