马上注册,结交更多好友,享用更多功能,让你轻松玩转社区。
您需要 登录 才可以下载或查看,没有账号?注册
×
31.1 引言
切口疝是腹部手术后最常见的并发症,发生率高达20%以上的易患因素包括肥胖,高龄,肺部疾病,类固醇使用,伤口感染和营养不良。 虽然不寻常,但未修复的疝气有嵌顿,阻塞或绞窄的风险。 因此,每年在美国进行30多万次腹疝修补,这是最常见的手术过程之一。 已经描述了多种用于疝修复的技术,涉及缝合闭合和假体网状材料。 一般来说,大多数修理的目标是获得筋膜的反对意见; 然而,在组织弹性有限或严重筋膜缺陷的情况下,一次闭合可能不可行,并且需要先进的外科手术,例如组件分离。
腹疝修复的原则包括病人的优化,明智的组织解剖和筋膜缺损的闭合,并使用假体材料进行加固。 无网格切口疝修补术具有不可接受的结果,超过50⁜%的患者复发,而使用网格可能使复发率降低近50⁜%。 虽然单纯疝修补术在大多数情况下是合适的,但复杂疝的患者通常需要局部组织前移才能成功地扩大和恢复腹壁。 这需要重新建立生理腹壁张力和动力学,从而改善伤口愈合并减少缺血性并发症。
组分分离技术是一种能够恢复这些特征的外科手术。成分分离技术允许腹壁的闭合,同时保持生理张力、神经支配和血管化。该程序导致修复最好模仿生理腹壁动力学。
组件分离技术也称为分离部件,依靠腹壁的物理特性来增加移动性。 腹壁由重叠的肌肉层组成,能够在维持血管化和神经支配的同时分离。 通过解剖肌肉层,单个单位的动员变得比整个单位的动员更大。 这样可以使腹壁进一步前移,并改善每侧的近似度。 位于外斜和内斜之间的相对非血管平面使得这种分离成为可能,并且可以获得每侧上总共10厘米的前进。 然而,由于直肌的节段性神经维管束以及位于该平面中的中下腹部,腹股沟和阴囊的感觉分支,腹内斜肌和横肌肌肉不应分开。
理想的情况下,腹直肌内侧斜横肌皮瓣的动员和近视将允许主要面部闭合。然而,在巨大的腹疝中,组件分离技术可能不足以完全消除缺陷。在这种情况下,可能需要桥接网格,尽管这是不寻常的。虽然不理想,但桥接的组件分离提供比单独桥接修复更可靠的疝闭合。部件分离的辅助部件将进一步最小化缺陷的尺寸并导致桥接网格的面积更小。然而,即使获得了主要的筋膜闭合,仍建议腹壁网状加固。网格可以定位成不仅加强中线封闭,而且加强导致外部斜肌分裂的任何潜在弱点。因此,通过推进腹壁和用假体网增强,腹壁半径减小并且腹壁厚度增加。这有助于根据拉普拉斯定律的原则限制复发(腹壁张力与壁半径成正比,与壁厚成反比)。
自从Ramirez等人发表组件分离技术的标志性时间以来, 已经描述了许多修改。 目前存在的三种主要成分分离技术是开放式前部成分分离技术,穿孔器保留(或备用)技术和内窥镜技术。 在每个程序中,目标是分离腹部肌肉层以获得更大的壁移动性。 差异在于用于实现该目的的方法,通过避免破坏皮瓣来减少伤口并发症。 尽管如此,每种技术仍然相关,因为每种技术可能最适合个性化患者情况。
31.2 开放性前部成分分离技术
31.2.1 概述
Ramirez等人。 最初描述了将腹壁解剖成用于动员腹直肌复合体的部件,以允许闭合复杂的腹壁缺陷。 该程序被誉为解决之前程序中出现的高复发率的解决方案。 然而,由于手术部位发生率高,包括血清肿,血肿和感染,该技术很快失宠。 最近,由于对恢复腹壁功能,实现生理张力和保持腹壁动力学的兴趣日益增加,这是利用组分分离技术实现的特征,因此最近出现了开放组分分离技术的复苏。
由于与该技术相关的相对较短的学习曲线,拉米雷斯分量分离技术经常用于修复复杂的腹壁疝。报道的拉米雷斯成分分离技术的适应症包括高风险老年人群,既往有多次腹部手术史的患者,以及需要最大进展的大型腹壁缺损。拉米雷斯成分分离技术已被广泛报道,并通过产生大的破坏性皮瓣,从直肌腹肌分离后直肌鞘以及从下面的内斜肌开放分离外斜肌提供最大的腹壁前进。手术的每个组成部分都会导致腹壁前移的增加,并且在双侧进行时三种元素中的每一种的组合可以允许闭合近20厘米宽的腹壁缺陷。
31.2.2 进化
在对组件分离技术进行初步描述之前,通过将腹壁作为独立单元推进来修复腹侧疝。 当闭合不可行时,选择包括放置假体网以桥接缺损,单独关闭缺损处的皮肤,或使用移植物或瓣。 由于网眼挤压,桥接网与频繁的并发症相关。 皮瓣的使用与额外的供体部位发病率有关。 成分分离技术显著降低了疝复发率,同时减轻了远端组织转移或桥网植入的需要。 在过去的三十年中,组件分离技术保持相对不变,除了最近推出的使用假体网状增强材料可以作为覆盖层,底层或腹膜下垫层。
31.2.3 技术
尽管也可以采用横向腹部切口,但是类似于腹疝修补的组件分离疝修补技术通常通过中线剖腹切口进行。进入腹腔并从后腹壁切下内脏。第一步涉及从前腹壁肌肉组织创建皮瓣(图31.1)。将皮肤和皮下组织从前腹直肌鞘和外斜肌切开至腋前线的近似水平(图31.2)。解剖横向延伸至侧向半月半径数厘米的距离,头侧至肋缘上方至少5厘米的距离,并且低于腹股沟韧带的水平。这些大的破坏性皮瓣的产生将导致几厘米的腹壁前进。接下来,将腹直肌与后直肌鞘分开,导致腹直肌的伸长。这是通过将后直肌鞘切入内侧1厘米以将其插入到白线中来实现的。在白线上使用Kocher钳通常有助于提供腹壁肌肉组织的牵引力。一旦切开后部直肌,可以在后部直肌鞘前部识别腹直肌。后直肌鞘切口延伸至肋骨边缘水平,优于和低于耻骨联合。

图31.1打开组件分离技术。 上图:(I)皮肤和皮下组织的分离。 (II)外斜肌腱膜的横断及内斜肌的外斜肌解剖。 (III)从腹直肌分离后鞘。 (IV)向中线前进10厘米。 底部:(A)腹直肌。 (B)外斜。 (C)内斜。 (D)腹横肌
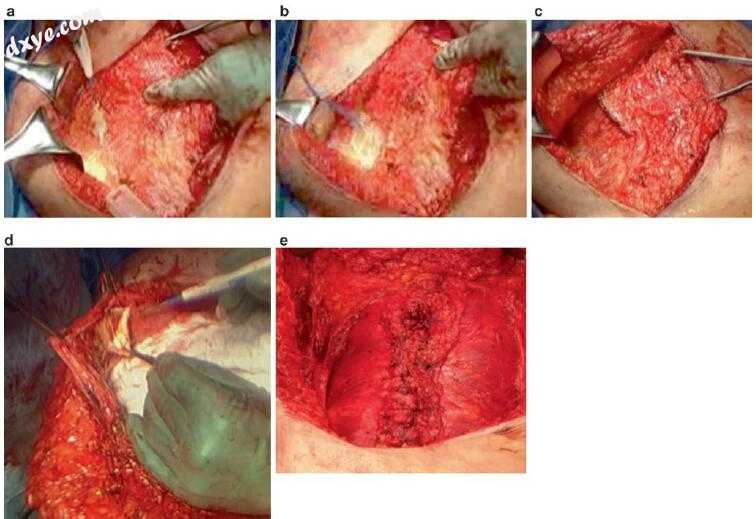
图31.2打开组件分离。 (a)半月板外侧的外斜肌腱膜的分割。 (b)在分开的外斜下方可见内斜腱膜。 (c)随着腹直肌复合体的进展完成外斜视分割。 (d)从腹直肌复合体解剖后直肌鞘。 (e)腹部闭合
横向地,从直肌腹部肌肉切开后直肌鞘,直到在隔间的外侧处遇到支配直肌的神经血管束。尽管偶尔牺牲单节段神经不会导致显著的功能障碍,但保留这些节段性神经血管束对于保持直肌的功能是必不可少的。后腹直肌鞘解剖可能会导致腹壁显著进展。但是,如果在此操作后出现大的缺陷或中线张力过大,外斜腱膜可能会分离以获得最大的释放。外斜向腱膜的分割是通过将外斜向至少2厘米的横向半球分开来完成的。外斜肌的内向定向纤维是识别外斜肌的肌肉和腱膜部分连接处的有用标志。在内侧,外斜肌腱膜与内斜肌腱膜和腹横肌腱膜(弓形线下)融合形成半月线。半月形线的分割可能导致明显的腹壁畸形,应该避免。
在肌肉的肌肉和腱膜部分的交界处进行外斜肌腱膜的分割,以防止对半月线的损伤。 切口向下延伸至腹股沟韧带,并且向上延伸至肋缘以上5cm的距离。 外斜肌与下斜肌之间的空间被广泛分开以获得最大的前进。 这个空间既没有神经也没有血管系统,很容易用钝器解剖。 解剖这个空间将导致显著更多的腹壁进展比分离的外部斜腱膜没有这种相关的解剖。 这种解剖创造了一个“滑动肌筋膜瓣”,包括腹直肌,内斜肌和腹横肌。
胸廓到肋骨边缘,胸廓可以防止疝气,直肌的外侧面被释放以允许从胸壁移动。 通过保留覆盖的筋膜附着物以保持胸肌与直肌之间的连续性,保持胸大肌的连续性。 这被称为“直肠前肌皮瓣”,并促进腹壁缺损的闭合。
在解剖和分离腹壁进入其组成部分后,通过近似左、右直肌内斜肌-横肌复合物来关闭腹壁。典型地,使用可缓慢吸收的缝线,尽管间断闭合可以考虑更具挑战性的闭合。外侧斜肌的外侧边缘侧向缩回。
非活皮肤被切除(通常包括脐),皮下封闭吸引引流被放置在皮下空间,然后皮肤闭合。
31.2.4 结果
开放式前室分离技术的结果表明,与以前的腹疝修复技术相比,其显著改进。张力筋膜瓣移位和闭合的先前结果导致复发率高达42⁜%,而在开放性组分分离中复发率为16⁜%。尽管如此,与其随后的进化技术,即穿孔保存和内窥镜组件分离程序相比,组件分离技术具有更高的复发率。此外,与穿孔器保存技术,内窥镜技术和其他传统疝修复技术相比,组件分离技术导致手术部位发生率高。与组件分离技术有关的手术部位发生包括血清肿,脓肿,血肿,蜂窝织炎,手术部位感染和皮肤坏死。虽然开放式组件分离技术通常与更长的住院时间相关,但与腹腔镜方法不同,手术室时间一般较短,并且不需要任何专门设备。
31.2.5 挑战与陷阱
开放性组件分离技术需要创建大的皮肤皮瓣,导致上腹部穿孔血管的分离(为中央腹壁皮肤提供血管性),创建死腔和广泛破坏皮下组织。虽然这在选定的患者中可以很好地耐受,但这可能归因于该技术所见的手术部位并发症发生率。上腹穿孔血管的损失留下仅由阴部动脉的肋间动脉和分支血管化的皮瓣。这种侧支流可能不足以维持活力,导致皮肤坏死。对手术的其他挑战包括侧面疝的风险。在解剖浅层内斜肌筋膜时需要注意,因为深部解剖会损伤腹直肌的节段神经支配或损伤Spigelian筋膜,增加了切口并发症和侧疝的风险。尽管存在退缩,开放式组件分离技术提供了许多优点,并允许在适当选择的患者中实现坚固的腹壁闭合。
31.3 穿孔器保存元件分离技术
31.3.1 概述
穿孔器保留开放式组件分离技术是由于在开放式前路手术患者中发生的伤口发病而发展的。在打开组件分离时,将侧面的皮下组织切开以达到外斜肌的腱膜。这种广泛解剖的从肋缘向耻骨延伸的脂肪皮瓣依赖于肋间动脉血管。腹膜后切口,肥胖或血管疾病导致腹壁血管损伤的患者可能更容易发生传统前间部分分离术后的缺血性伤口并发症。穿孔保存技术通过减少皮下死腔和避免穿支血管横切来改善开放方法。在Maas等人首先提出的射孔保持成分分离技术中,并由Saulis和Dumanian以及后来的Butler和Campbell修改,通过避开脐周围3cm半径来挽救上腹穿支血管。供应前腹壁皮肤的穿孔血管通常位于脐周区域并且由深部上腹血管产生。保持这些穿孔血管有助于保护脂肪皮瓣的血管。该程序优化了脉搏血流到腹壁皮肤,因此改善了伤口愈合而不损害该程序的益处。
31.3.2 演化
如第一次描述的那样,穿孔器保存技术通过放置在侧腹壁上的分开的横向切口进行。 该切口通过皮肤,皮下组织和外斜肌筋膜暴露内外斜肌之间的空间(图31.3)。 将解剖器放置在外斜肌下方并在内斜肌上方以解剖此“斜间”空间。 在去除球囊之后,在视频 - 内窥镜控制下,将外斜腱膜从腹股沟韧带延伸至肋缘至半边缘的半月线外侧切开。 这导致了血管化良好的化合物皮瓣可以推进到中线。 这种技术需要使用气球解剖器和视频内窥镜设备,通过这个2-4厘米的外侧切口暴露外斜肌和腱膜。
自Maas对内窥镜辅助组分分离技术进行初步描述以来,已经开发了许多其他技术。 其中许多手术涉及侧腹壁上的反切口以解剖并暴露半月线和侧腹壁。 2011年,Butler和Campbell描述了嵌入式生物假体网格(MICSIB)的微创组件分离。 该技术涉及通过中线剖腹手术在直肠鞘两侧创建横向隧道以避免反切口,同时允许植入生物假体网。 这个程序限制了切口进入腹壁,同时通过假体网的放置增加了修复的强度。

图31.3微创分离技术。 上:(I)通过皮肤,皮下组织和外斜腱膜切开。 (II)从内斜角解剖外斜。 (III)从腹直肌分离后鞘。 (IV)向中线前进10厘米。 底部:(A)腹直肌。 (B)外斜。 (C)内斜肌。 (D)腹横肌
31.3.3 技术
通过执行剖腹手术并裂解内脏和腹壁之间的粘连,用于穿孔器保持组件分离的技术类似于开放组件分离开始。然后将皮肤和皮下脂肪从前直肌筋膜上剥离,以清楚地识别半月线处的直肌边缘。外侧和平行于半月形线,在外斜肌筋膜上,直接在上下形成皮下袋。然后在耻骨上区域的上方创建第二次进入半月线的脐周直肌外穿孔。通过从直肌筋膜剥离皮下脂肪直到半月线被识别,以相同的方式完成。然后通过在脐周直肌腹侧穿支血管的外侧创建皮下隧道,将下方接入部位与上方接入部位连接。然后将外斜腱膜切开到侧半球外侧以进入内斜肌和外斜肌之间的空间。将Yankauer吸引装置引入倾斜间隙中,并用于将半月线向内缩回,从而允许侧向分开外侧斜向腱膜。一旦分离,将外斜肌和腱膜的长度从肋缘以上切开至腹股沟韧带。然后将切开的外侧外倾斜边缘与内斜直接分开以允许直肌肌肉组织的最大内侧前进。推进后,面板关闭。巴特勒和坎贝尔描述了用断断续续的尼龙缝线缝合筋膜闭合,放置三个封闭吸引,清除多余或缺血性皮肤,以及皮肤闭合。其他闭合技术包括以中断或跑步方式放置的缓慢吸收或永久性单丝缝合线。
31.3.4 结果
有限的研究将穿孔器保存组件分离技术与开放式或内窥镜技术相比较。 然而,很明显,与开放式组件分离相比,穿支器保存技术降低了手术部位的发生。 在一项研究中,与开放手术相关的伤口并发症发生率相比,穿支伤口保存法的伤口并发症发生率高达27⁜%。 这可能是由于上腹部穿孔血管的成功保留以及随后皮肤坏死的减少。 然而,由于外斜肌的有限暴露和可视化,创建皮下隧道在技术上可能是困难的。 但这种解剖的简单性只需要一个牵开器和一个Yankauer吸头来露出并分开外斜,这就增加了这种方法的吸引力。
进行解剖所需的手术时间可能会增加,相对于开放式组件分离,穿支器保持组件分离,但术后并发症的减少超过术中时间的适度增加。
虽然射孔保存技术的不良后果与开放隔室分离技术相比有所减少,但学习曲线陡峭。 当外科医生开发该技术的经验时,可以预期结果的可变性。 另一个挑战涉及在中线直肌闭合后切除多余的腹壁皮肤。 通常切除先前的手术疤痕和多余的皮肤,但在切除腹壁的脂肪皮肤组织时保留脐周穿孔可能是困难的。 然而,留下的未去除,多余的腹壁皮肤可能会导致皮下血管瘤在皮下被剥落。 在确定皮肤切除范围时,应评估残余腹壁断流风险与术后血清肿风险之间的关系。
31.3.5 挑战和陷阱
穿孔器保存技术的执行可能具有挑战性。 通过中线创建隧道需要一个大的隧道,以提供足够的外部斜向腱膜的可视化。 在腹侧外侧壁上放置额外的切口可能有助于肥胖患者或外侧腹壁肌肉组织显著收缩的病例。
通常有四对或五对穿孔血管位于脐周区域。 一般应避免直接解剖和观察穿支血管,以避免无意伤害,牵引损伤或血栓形成。 建议避免在脐孔上方和下方数厘米处剥离皮下组织。 虽然大多数血管位于脐周位置,但偶尔还会遇到额外的船只。 在可行的情况下,应保留任何主导血管。 灌注扫描技术的使用可能是一个有用的辅助手段,以帮助识别血管并确保完成解剖后可行的皮瓣。
31.4 内窥镜组件分离技术
31.4.1 概述
在Ramirez等人的25年中, 引入了开放式组件分离技术,该技术已显著发展,努力减少伤口发病率,同时保持腹壁闭合肌筋膜前移的益处。 内窥镜组件分离程序已经成为开放组件分离以修复腹疝的有利方法,这归因于可比的疝复发率降低的发病率。 内窥镜组件分离技术是一种易于学习的穿孔器保存技术,可利用视频内窥镜设备在直接观察下方便外部斜向腱膜的分割。
31.4.2 演化
通过内窥镜组件分离的最早描述腹疝修复的方法可以追溯到2000年。第一份报告详细介绍了一种利用位于腋中线的皮下气囊解剖器的技术,该技术从上覆的软组织中直接解剖外斜肌和腱膜(图31.1)。然后将腱膜完全分割为半月线与从肋缘至髂前上棘水平的电烙术。这个最初的系列报告显示伤口感染,血清肿率和坏死明显减少,但不影响疝复发率。但是,该技术当时并未被广泛采用。基于Maas等人的内镜组件分离技术随后报道了内窥镜组件分离技术的改进,其中描述了感染腹壁疝的管理技术。在该描述中,在肋缘下方1厘米处切开腹壁,以识别外斜肌。在外部斜向纤维分开之后,利用气球解剖器解剖斜向间隙(图31.2)。去除气球解剖器后,将额外的套管针放入斜间空间以适应外斜腱膜的分裂。本报告详细描述了七名患者,尽管患者群体复杂,但尽管术后伤口发病率很低,但仍进行了内镜组件分离,并且显著促进了手术的普及。
31.4.3 技术
内窥镜组件分离技术可用作开放式和腹腔镜腹疝修补术的辅助手段。 腹直肌筋膜复合体的肌筋膜移行促进了中线筋膜的紧贴和近似,同时减少了张力。 与许多先进的腹腔镜手术不同,内窥镜组件分离技术很容易掌握,学习曲线相对较短。
患者仰卧位置,双臂腋窝以便于暴露整个腹部和下胸部。 腹腔镜和开放手术的定位相似。 在开腹腹疝修补术中,在进行内窥镜组件分离之前进行中线剖腹手术和疝清除术。 然而,当在腹腔镜腹疝修补期间利用内窥镜组件分离时,通常在腹腔注入之前执行内窥镜释放,因为用于腹腔镜疝修复的外侧套管针放置会导致二氧化碳泄漏,这可能限制外侧的扩张内镜组件分离过程中的腹壁。
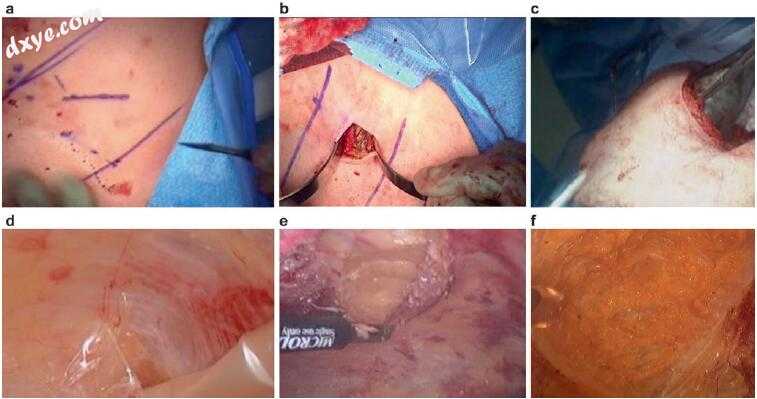

内窥镜组件分离(图31.4和31.5)
1. 约2厘米切口约5厘米头到肋缘外侧半月线外侧。这通常位于锁骨中线和腋窝中线之间,但应根据疝的特点进行修改,以确保切口覆盖在外斜面上。切口的内侧放置可能导致直肌鞘的解剖。
2. 通过皮下和Scarpa筋膜进行皮下解剖,以识别外斜肌组织。外斜肌始终在肋缘上方肌肉,这有助于识别逆取向纤维。外斜纤维被直接解剖以暴露下面的筋膜。
3. 球囊剥离器通过解剖的外侧斜纤维直挺挺地前进,并平行于半月线向腹股沟韧带推进。当内斜肌纤维直接插入四个最低肋骨时,气囊剥离器将进入肋间倾斜空间,因为它位于肋骨边缘以下。这种技术用于初始端口放置的优点在于,当通过腹壁和外部斜纤维进行解剖时,由于其肌肉外观和胸笼的反阻力,容易识别外斜肌。
4. 在直接视频内窥镜下显示解剖气囊。外部倾斜纤维清楚地可视化,创建横向腹肌的板与内部斜肌包括板。由于血管的缺乏,这个空间容易解剖,出血最少;这些肌肉的血液供应横向进入。
5. 在取出球囊剥离器后,在最初的切口部位插入气囊尖端套管针,并将腹壁的二氧化碳吹入至12毫米汞柱。
6. 一个额外的端口被插入在侧腹在前腋窝线紧邻肋缘。然后将该端口用于外斜腱膜的分割。
图31.4内窥镜部件分离技术。(a)左侧切口位于半月线外侧至肋缘5 cm处。(b)外斜肌纤维的暴露。(c)
图31.5顶部:(I)内斜的外斜的钝性解剖。 (II)内窥镜组件分离气囊的插入和吹入。 底部:(A)腹直肌。 (B)外斜肌。 (C)内斜肌。 (D)腹横肌气囊解剖器插入。 (d)气球解剖已完成。 (e)外部斜线划分。 (f)完成外部斜向释放
7. 外斜腱膜被肋骨边缘以上的剪刀或烧灼分开,并被尾部延伸至腹股沟韧带。 腹壁的最大推进是通过在分开外斜肌腱膜之后分割覆盖的皮下组织和Scarpa筋膜获得的。
两个端口在上腹部的放置通过允许解剖单向进行从肋骨边缘上方开始并沿着朝向骨盆的尾部方向继续实现内窥镜组件分离。 这种端口放置将避免由针对视频内窥镜的仪器导致的“镜像”造成的挑战。尽管可以放置附加端口以便于解剖,但在大多数情况下,可以执行双端口方法。 腹腔外侧通常不需要术后引流。
31.4.4 结果
尽管腹疝修复的频率很高,但关于内窥镜组件分离技术的功效的证据有限。 Feretis和Orchard对文献进行的系统回顾分析了33篇文献,涉及220例患者,发现与微创组件分离/开放组件分离相比,内镜组件分离减少了术后伤口并发症发生率,与对照组相比,增加了疝复发风险到微创成分分离,尽管其他人发现在比较内镜成分分离和开放成分分离时没有增加疝复发的风险。据报道,在内镜组件分离程序中,术后并发症包括肺部,肾脏,心脏和胃肠道问题的发生率较低,据报道可改善整体生活质量。在一项研究中,与一般人群相比,几乎所有患者的术前评分都有所提高,包括精神和一般健康知觉,疼痛,活力和身体/社会功能。内镜组件分离不仅与患者的整体健康益处相关,如减少疤痕,保留解剖结构和血管,还减少术后疼痛。尽管需要专门的设备,与开放式组件分离相比,内窥镜组件分离成本更低。
31.4.5 挑战和隐患
内镜组件分离技术非常适合修复中线腹疝。尽管不是禁忌症,但是先前的横切口增加了执行内窥镜组件分离的技术难度。在内窥镜组件分离之后,网格布置被限制在逆行空间或腹膜内位置。在逆向植入空间中放置增强网格不会加强横向释放的外斜肌。然而,完整的腹内斜肌和横肌肌肉通常足以防止侧疝凸起和疝气。也可以进行腹膜内网片放置,但是逆行网片放置通常与较低的疝复发率有关。我们通常利用内窥镜组件分离作为Rives-Stoppa腹疝修补的辅助手段。执行内镜组件分离的决定基于腹直肌后腹直肌鞘切开后中线切口的张力程度,这与Ramirez等人的初步报告类似。在解剖复位直肠后,外斜行分开。进行内镜组件分离的患者不能进行镶嵌网布置,因为该空间未被解剖,而进行开放组件分离疝修补的患者可以进行镶嵌网布置,从而加强分开的外斜肌。没有报道比较成分分离疝修补术后特异性分析网片位置的结果。此外,位于偏离中线的疝气患者可能更适合替代疝修补术,因为内窥镜组件分离对于将直肠复合体向中线推进是最有利的。
31.5 结论
腹疝对外科医生来说很常见并且具有挑战性,经常导致复发和并发症。成分分离技术是一种有用的辅助手段,可促进中线闭合并在生理张力下形成动态腹壁修复。近几十年来,先前的组件分离技术已显著发展,努力减少伤口发病率。虽然与较高的发病率有关,但最初描述的开放式组件分离技术可用于适当选择的患者以最大限度地促进腹壁肌肉组织。尽管与其他技术相比使用频率较低,但是开放式组件分离技术对于因疝囊的自然分离或伴随着胰腺切除术的患者而无法避免皮瓣的患者很有用。保留前部组件分离技术的内镜和穿支器可产生类似的长期结果,尽管短期发病率降低。在考虑疝修补的最佳方法时,外科医生的经验和培训以及患者人群的变异性是不容忽视的。每种修复技术在术前,手术室和术后需要大量资源。由于与腹壁重建相关的挑战,复杂的疝修复患者经常在大量疝中心治疗中心进行治疗。
参考:Textbook of Hernia |


